
【题目】实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( )

A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
D.酸性KMnO4溶液若倒吸可加快褪色速率
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应:![]() 并达到平衡。
并达到平衡。
(1)平衡后,向容器中充入1mol![]() ,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)______判断该反应达已经到平衡状态。若初始时加入的![]() 为2.84g,10分钟后达到平衡时
为2.84g,10分钟后达到平衡时![]() 的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,
的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A. 当有0.8mol电子转移时,b极产生4.48LO2
B. 为了增加导电性可以将左边容器中的水改为NaOH溶液
C. d极上发生的电极反应是:2H+ +2e-=H2
D. c极上进行氧化反应,A池中的H+可以通过隔膜进入B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如图:

回答下列问题:
(1)步骤Ⅰ制备的Ca2Fe(CN)6易溶于水吗?__(填“易溶”或“不易溶”)。
(2)步骤Ⅲ的化学方程式为__。
(3)步骤Ⅴ所用的试剂X是__(填化学式)。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:

①HCN的电子式为__。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是__,第二步反应的离子方程式为__。
(5)已知蓝色染料普鲁士蓝的合成方法如图:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如图:
![]()
若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请用离子方程式解释检测时试纸变蓝的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
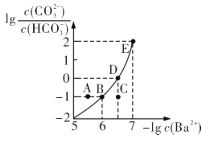
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个________,还有一种状态叫做________。
(2)写出![]() 原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与
原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与![]() 同周期的所有副族元素的基态原子中,最外层电子数与
同周期的所有副族元素的基态原子中,最外层电子数与![]() 相同的元素有_________种。
相同的元素有_________种。
(3)下列![]() 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
A 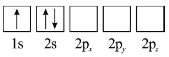 B
B 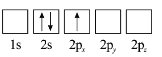
C 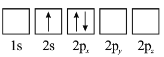 D
D 
Ⅱ.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层![]() 能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成
能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成![]() 型化合物,并知在
型化合物,并知在![]() 中,
中,![]() 与
与![]() 的质量比为
的质量比为![]() 原子的价电子排布式为
原子的价电子排布式为![]() 。根据以上条件,回答下列问题:
。根据以上条件,回答下列问题:
(1)C的基态原子的电子占据最高能层的符号为_______,![]() 原子的价电子排布图________。
原子的价电子排布图________。
(2)A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示)。
(3)元素B和D的电负性由大到小的顺序_________(用元素符号表示)。
(4)写出E的元素符号_________,要证明太阳光中含有E元素,可采用的方法是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com