


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

 为平面结构,则W分子中最多有
为平面结构,则W分子中最多有



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

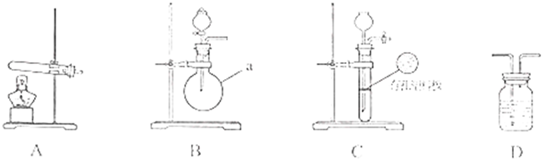
| 实验装置 | 实验药品 | 制备原理 | |||||||||
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① (NH4)2SO4+Ca(OH)2
(NH4)2SO4+Ca(OH)2
| ||||||||
| 乙小组 | ② B B |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
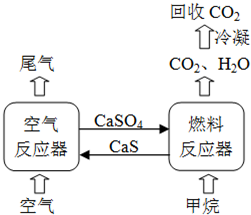 (2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的.
(2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的.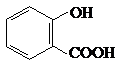 .
.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com