
【题目】分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有( )
A. 3种 B. 4种 C. 5种 D. 6种
科目:高中化学 来源: 题型:
【题目】关于能源的利用,下列说法中错误的是
A.由于我国煤和石油的储量十分丰富,所以太阳能和核能的开发在我国并不十分重要
B.能源的利用过程,实质上是能量的转化和传递过程
C.现在人类社会使用的能源主要是煤、石油和天然气
D.煤、石油和天然气的化学能归根到底来自太阳能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是人类的三大营养物质之一,以下有关油脂的叙述中,错误的是( )
A. 油脂属于酯类
B. 某些油脂兼有酯和烯烃的一些化学性质
C. 油脂的氢化又叫油脂的硬化
D. 油脂是纯净物,不是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
硫铁矿
![]()
![]()
![]()
![]()
![]()
 Na2S2O3·5H2O
Na2S2O3·5H2O
已知:Ⅰ.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_______________________________。
(2)吸收塔中的原料B可以选用________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。

①使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是____________________。装置B的作用是______________________。
②C中制备Na2S2O3发生的连续反应的化学方程式有Na2S+H2O+SO2===Na2SO3+H2S、2H2S+SO2===3S↓+2H2O (或)2H2S+H2SO3===3S↓+3H2O和___________________________________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
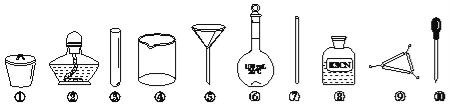
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种物质;①甲烷②苯③聚乙烯④乙烯⑤氯乙烷⑥甲苯⑦环己烯。因为发生化学反应,既能使酸性高锰酸钾溶液褪色又能使溴水褪色的是( )
A. ③④⑦ B. ④⑤⑦ C. ④⑦ D. ④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
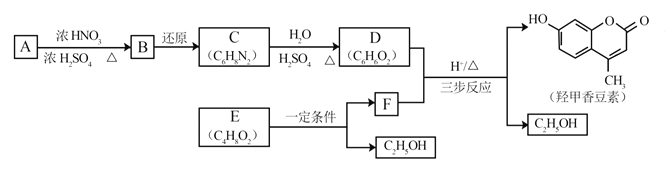
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
已知: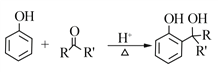
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是_______________。B中所含的官能团是___________。
(2)C→D的反应类型是________________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com