甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H
2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H
2(g)?CH
3OH(g)△H
1=-116kJ?mol
-1(1)一定温度下,将2mol CO和一定量H
2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
.
若在相同温度下,上述反应改在体积为2L的恒容密闭容器中进行,平衡常数
(填“增大”“不变”或“减小”);反应10s后CO的物质的量为l.2mol,则0~10s的平均反应速率v(H
2)=
.
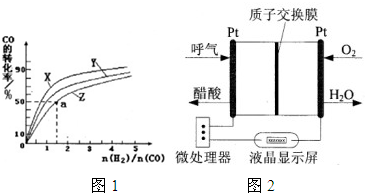
(2)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三种温度下不同的H
2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.
请回答:
①在上述三种温度中,曲线X对应的是
.
②利用图1中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H
2(g)?CH
3OH(g)的平衡常数K=
.
(3)已知:CO(g)+
O
2(g)=CO
2(g);△H
2=-283kJ?mol
-1H
2(g)+
O
2(g)=H
2O(g)△H
3=-242kJ?mol
-1则表示1mol气态甲醇完全燃烧生成CO
2和水蒸气时的热化学方程式为
;
(4)乙醇燃料电池具有很高的实用价值.如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为
.

 钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.
钠在空气中燃烧(右左图)生成产物的固体物质中除有黄色粉末外,还有黑色固体物质.
