
【题目】已知HX和HY是两种一元弱酸,常温下用NaOH溶液分别滴定这两种弱酸溶液,若pKa=-lgKa,y=![]() 或lg
或lg![]() ,得到y和溶液pH的变化关系如图所示。下列有关叙述错误的是( )
,得到y和溶液pH的变化关系如图所示。下列有关叙述错误的是( )
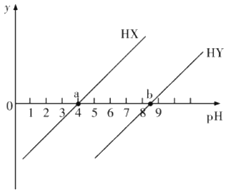
A.常温下,Ka(HX)=10-4,Ka(HY)=10-8.5
B.a点溶液中,c(X-)=c(HX)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/LNaX溶液pH大于0.1mol/LNaY溶液的pH
D.往HY溶液中滴入NaOH溶液后所得的混合溶液中,![]() =10pH-pKa(HY)
=10pH-pKa(HY)
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
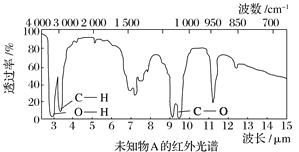
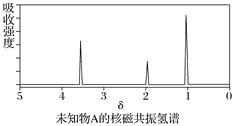
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定时,眼睛观察锥形瓶中溶液颜色的变化
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香酚存在于丁香花的花蕊中,以丁香酚为原料制取有机物 F 的路线如下:

已知:![]()
(1)丁香酚的分子式为_______。
( 2) A 中的含氧官能团是_______( 填名称), ② 的反应类型为_______。
(3)写出满足下列条件的 C 的所有同分异构体的结构简式_______。
①含苯环且环上只有两个取代基;
②属于酯类化合物;
③核磁共振氢谱有 3 组峰,且峰面积之比为 3∶1∶1。
(4)1 mol D 最多可以与_______molH2 发生加成反应。
(5)反应⑤中,试剂 X 的结构简式为_______。
(6)设计用呋喃甲醛( ![]() )和环己醇为原料制
)和环己醇为原料制 ![]() 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟的“人工树叶”电化学装置如图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极。已知装置的电流效率等于生成产品所需的电子数与电路中通过的总电子数之比。下列说法不正确的是( )

A.该装置中Y电极发生氧化反应
B.X电极的电极反应式为6CO2+24e-+24H+=C6H12O6+6H2O
C.理论上,每生成22.4LCO2必有4molH+由Y极区向X极区迁移
D.当电路中通过3mol电子时生成18gC6H12O6,则该装置的电流效率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为一种盐,C、D、F、N、O在常温常压下均为无色气体,E在常温常压下为无色、无味的液体,N、H、L为高中常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
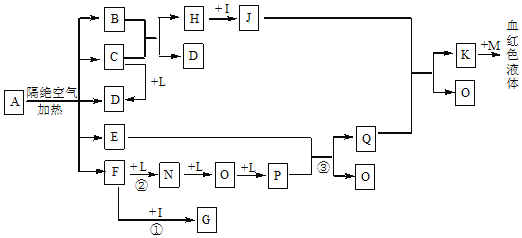
(1)写出D的电子式:___;
(2)写出反应②的化学方程式:___;
(3)已知B中氧元素的质量分数为22.2%,且A分解产生的各物质的物质的量之比为n(B):n(C):n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为甲烷和![]() 构成的燃料电池示意图,电解质为KOH溶液,图2为电解
构成的燃料电池示意图,电解质为KOH溶液,图2为电解![]() 溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
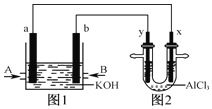
A.图1中电解质溶液的pH增大
B.图2中电解![]() 溶液的总反应为
溶液的总反应为![]()
C.A处通入的气体为![]() ,电极反应式为
,电极反应式为![]()
D.电解池中![]() 向x极移动
向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
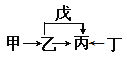
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素,则E为钠元素;根据流程图推导,且甲是生活中的调味品,丁是淡黄色固体,可知甲为氯化钠,丁为过氧化钠,则丙为碳酸钠,乙为氢氧化钠,戊是二氧化碳,则A、B、C、D、E、F分别为H、C、N、O、Na、Cl。A. 同周期性元素从左到右原子半径逐渐减小,同主族元素从上而下原子半径逐渐增大,故原子半径由大到小的顺序为:r(Na)>r(Cl)>r(N)>r(O),选项A正确;B. 元素Cl的最高价氧化物的水物化的酸性一定比硫酸酸性强,若不是最高价氧化物的水化物,则可能比较弱,如HClO是弱酸,选项B不正确;C. 元素B的氢化物CH4具有正四面体结构,选项C正确;D. 化合物A4BC2D既可能是共价化合物CO(NH2)2,也可是离子化合物NH4CNO,选项D正确。答案选B。
【题型】单选题
【结束】
6
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是

A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为:
2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol/(Ls)
②v(B)=0.6mol/(L·s)
③v(C)==0.4mol/(L·s)
③v(D)=0.45mol/(Ls)
下列有关反应速率的比较中正确的是
A.④>③>②>①B.④<③=②<①C.①>②>③>④D.④>③=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com