
【题目】现向含S2-、Fe2+、Br-、I-各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是
A. 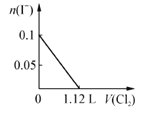 B.
B. 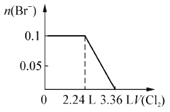
C. 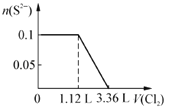 D.
D. 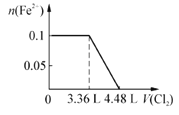
【答案】D
【解析】试题分析:S2—、Fe2+、Br—、I—的还原性的大小关系是S2—>I—>Fe2+>Br—,根据离子的还原性的顺序,氯气逐一与之反应。A、氯气首先氧化硫离子,A错误;B、硫离子与氯气发生置换反应,所以0.1mol硫离子需要0.1mol氯气,标准状况下的体积是2.24L,0.1mol碘离子需要0.05mol氯气,标准状况下的体积是1.12L, 0.1mol亚铁离子被氧化,失去0.1mol电子,需要0.05mol氯气,标准状况下的体积是1.12L,将硫离子、碘离子、亚铁离子全部氧化时需要氯气的体积是2.24+1.12+1.12=4.48L,0.1mol溴离子被氧化需要0.05mol 氯气,标准状况下的体积是1.12L,所以通入氯气4.48L时溴离子的物质的量开始减少,到5.6L时,变为0,B错误;但氧化亚铁离子时先氧化硫离子和碘离子,所以通入3.36L氯气时,亚铁离子的物质的量开始减少,错误;C、氯气首先氧化硫离子,C错误;D、根据以上分析, D正确,答案选D。


科目:高中化学 来源: 题型:
【题目】能用离子方程式OH+H+ = H2O表示的反应是
A.稀盐酸和稀氨水反应
B.稀硫酸和烧碱溶液反应
C.稀硫酸和氢氧化铜反应
D.稀硫酸和氢氧化钡溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为___________ 。丁二酮肟分子中C原子轨道杂类型为 ____________,1mol丁二酮肟分子所含![]() 键的数目为 ____________,分子中各原子的电负性由大到小的顺序为______________。
键的数目为 ____________,分子中各原子的电负性由大到小的顺序为______________。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 __________晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 ________________(填化学式)。
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 ____________。
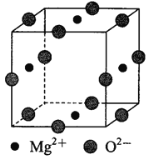
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)
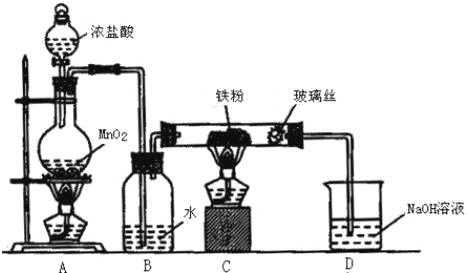
该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化能体现物质的漂白性的是:
A. SO2使酸性KMnO4溶液褪色 B. 乙烯使澳水褪色
C. Na2O2使无色酚酞先变红,后褪色 D. SO2使NaOH酚酞溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法正确的是( )
A. 制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O = Fe(OH)3↓+3HCl
B. 利用半透膜不可以除去淀粉溶液中的KNO3
C. 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
D. 胶体属于介稳体系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com