
【题目】实验室配制1mol/L盐酸250mL,下列不需用的仪器是( )
A.250mL容量瓶
B.托盘天平
C.胶头滴管
D.烧杯
科目:高中化学 来源: 题型:
【题目】实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置______(填代号)和制备并收集干燥、纯净Cl2的装置______(填代号)。
可选用制备气体的装置:


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是
A.赤铁矿的主要成分是Fe3O4
B.除去FeCl2 溶液中的FeCl3杂质可以向溶液中加锌粉,然后过滤
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )
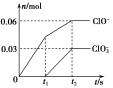
A.苛性钾溶液中KOH的物质的量是0.09 mol
B.ClO![]() 的生成是由于氯气的量的多少引起的
的生成是由于氯气的量的多少引起的
C.在酸性条件下ClO-和ClO![]() 可生成Cl2
可生成Cl2
D.反应中转移电子的物质的量是0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三种溶液中各含有Cl﹣、Br﹣、I﹣中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
A.Cl﹣、Br﹣、I﹣
B.Br﹣、I﹣、Cl﹣
C.Br﹣、Cl﹣、I﹣
D.Cl﹣、I﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.BaSO4难溶于水,BaSO4属于非电解质
B.非电解质的水溶液一定不导电
C.电解质主要包括:酸、碱、盐和部分氧化物
D.电解质在任何情况下均一定导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH=AlO2+H2
C.铁锈溶于盐酸中:Fe2O3+6H+=2 Fe 3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
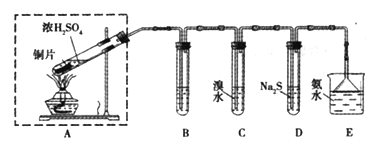
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
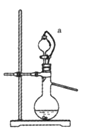
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
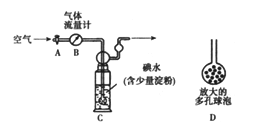
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________。
(2)DA2分子的VSEPR模型是____________。H2A比H2D熔沸点高得多的原因是____________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
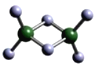
① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_____________。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
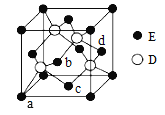
① 在该晶胞中,E的配位数为______________。
② 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com