
【题目】在甲、乙、丙三种溶液中各含有Cl﹣、Br﹣、I﹣中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
A.Cl﹣、Br﹣、I﹣
B.Br﹣、I﹣、Cl﹣
C.Br﹣、Cl﹣、I﹣
D.Cl﹣、I﹣、Br﹣
科目:高中化学 来源: 题型:
【题目】为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用 ( )
A.H2O2溶液 B.KMnO4溶液
C.氯水 D.HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止月饼等富含油脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是( )
A.维生素C
B.还原铁粉
C.亚硫酸钠
D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有NH![]() 、SO
、SO![]() 、SiO
、SiO![]() 、Br-、CO
、Br-、CO![]() 、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有NH![]() 、Na+;②有胶状物质生成;③有气体产生;④溶液颜色发生变化; ⑤共发生了2个氧化还原反应。
、Na+;②有胶状物质生成;③有气体产生;④溶液颜色发生变化; ⑤共发生了2个氧化还原反应。
A.①②③④ B.②③④
C.①③⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

(1)双氧水的电子式为 ;Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:__________________________________;
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析,其原因是__________________________________。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”、“不相同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.请根据化学反应与热能的有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是_________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③铝粉与氧化铁粉末在高温下反应
④酸碱中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)观察下图,计算1molH2与1molCl2反应_______(“吸收”或“释放”)的能量为_________。
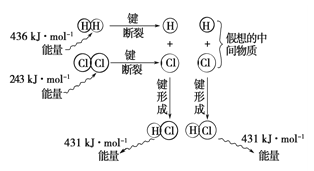
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排列式错误的是
A. Na+1s22s22p6 B. F-1s22s22p6
C. N3+ 1s22s22p6 D. O2-1s22s22p6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com