
【题目】下列各原子或离子的电子排列式错误的是
A. Na+1s22s22p6 B. F-1s22s22p6
C. N3+ 1s22s22p6 D. O2-1s22s22p6
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三种溶液中各含有Cl﹣、Br﹣、I﹣中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
A.Cl﹣、Br﹣、I﹣
B.Br﹣、I﹣、Cl﹣
C.Br﹣、Cl﹣、I﹣
D.Cl﹣、I﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1 min后鼓入空气。


请回答下列问题:
(1)实验时,常常将甲装置浸入70~80 ℃的水浴中,目的是___________________;由于装置设计上的缺陷,实验进行时可能的情况:__________________________。
(2)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。解释鼓气速度过快,反应体系温度反而下降的原因:_______________________________________。
(3)如何检验丙中生成的物质中有醛类物质:______________________________。
(4)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.某元素从化合态变成游离态,该元素一定被还原
C.由同种分子构成的物质一定是纯净物
D.电离时能生成H+的化合物一定是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________。
(2)DA2分子的VSEPR模型是____________。H2A比H2D熔沸点高得多的原因是____________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
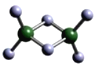
① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_____________。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
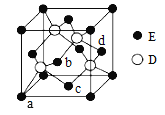
① 在该晶胞中,E的配位数为______________。
② 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是

A. 加入催化剂可以使状态 d 变为状态 b
B. 若 T1>T2,则逆反应一定是放热反应
C. 达到平衡时 A2 的转化率大小为: b>a>c
D. 在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) =Si3N4(s)+12HCl(g)+Q(Q>0)完成下列填空:
(1)写出N2的电子式:___________________,写出SiCl4的结构式:______________。
(2)由氮化硅(Si3N4)陶瓷的用途可推测其晶体类型为________。
a.离子晶体 b. 原子晶体 c.分子晶体 d.金属晶体
(3)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min)。
(4)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(5)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,正反应速率减小
b.其他条件不变,温度升高,正、逆反应速率都增大
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(6)若平衡时H2和HCl的物质的量之比为![]() ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___![]() (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com