
【题目】I.请根据化学反应与热能的有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是_________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③铝粉与氧化铁粉末在高温下反应
④酸碱中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
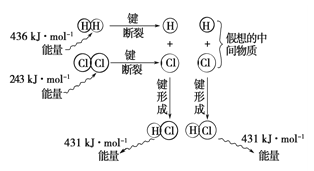
(6)观察下图,计算1molH2与1molCl2反应_______(“吸收”或“释放”)的能量为_________。
【答案】 ① B 小于 < S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1 释放 183kJ
【解析】I.(1)煅烧石灰石制生石灰是吸热反应,其余均是放热反应,答案选①;(2)氢气燃烧放热,又因为反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据方程式2H2+O2=2H2O可知2Q1+ Q2<4 Q3,答案选B;
II.(3)反应是放热反应,则该反应生成物的能量总和小于反应物的能量总和。(4)由于液态水转化为气态水需要吸热,因此若2mol氢气完全燃烧生成水蒸气,则放出的热量<572kJ。
III.(5)燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时所放出的热量,已知16g固体硫即0.5molS完全燃烧时放出148.4kJ的热量,则表示硫的燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1。(6)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据示意图可知该反应的反应热=(436+243-2×431)kJ/mol=-183kJ/mol,所以1molH2与1molCl2反应释放的能量为183kJ。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(10分)Ⅰ.1100 ℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2 (g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
A.容器内气体压强不再变化
B.H2的体积分数不再变化
C.1 mol H-H键断裂同时2 mol H-O键形成
D.Na2S的质量不再变化
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三种溶液中各含有Cl﹣、Br﹣、I﹣中的一种,向甲溶液中加入淀粉溶液和氯水时,溶液变成橙色,再加入乙溶液时,溶液颜色没有明显变化,则甲、乙、丙溶液中依次含的离子为( )
A.Cl﹣、Br﹣、I﹣
B.Br﹣、I﹣、Cl﹣
C.Br﹣、Cl﹣、I﹣
D.Cl﹣、I﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH=AlO2+H2
C.铁锈溶于盐酸中:Fe2O3+6H+=2 Fe 3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A. 18O、31P、119Sn B. 27Al、19F、12C
C. 6C、16S、9F D. 1H、13C、35Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
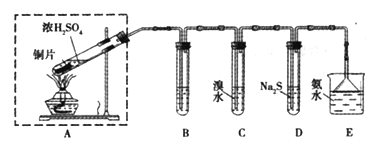
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
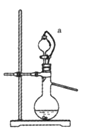
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
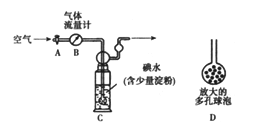
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1 min后鼓入空气。


请回答下列问题:
(1)实验时,常常将甲装置浸入70~80 ℃的水浴中,目的是___________________;由于装置设计上的缺陷,实验进行时可能的情况:__________________________。
(2)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。解释鼓气速度过快,反应体系温度反而下降的原因:_______________________________________。
(3)如何检验丙中生成的物质中有醛类物质:______________________________。
(4)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) =Si3N4(s)+12HCl(g)+Q(Q>0)完成下列填空:
(1)写出N2的电子式:___________________,写出SiCl4的结构式:______________。
(2)由氮化硅(Si3N4)陶瓷的用途可推测其晶体类型为________。
a.离子晶体 b. 原子晶体 c.分子晶体 d.金属晶体
(3)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min)。
(4)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(5)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,正反应速率减小
b.其他条件不变,温度升高,正、逆反应速率都增大
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(6)若平衡时H2和HCl的物质的量之比为![]() ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___![]() (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com