
【题目】(10分)Ⅰ.1100 ℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2 (g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
(1)下列能判断反应达到平衡状态的是________。
A.容器内气体压强不再变化
B.H2的体积分数不再变化
C.1 mol H-H键断裂同时2 mol H-O键形成
D.Na2S的质量不再变化
E.υ(正)=υ(逆)
F.容器内气体密度不再变化
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为: 。
Ⅱ.丙烷燃料电池,以KOH溶液为电解质溶液。
(3)通入丙烷的电极为_____(填“正极”或“负极”),正极的电极反应式为 。
(4)燃料电池的优点________。
(5)若开始时电解质溶液中含KOH的物质的量为0.25 mol,当溶液中K2CO3的物质的量为0.1 mol时,消耗标准状况下丙烷的体积为 mL(保留一位小数)。
【答案】(1)BDEF;(2)0.125 mol/(L·min);(3)负,O2+4e-+2H2O=4OH-;
(4)能量转化率高,环境友好;(5)746.7。
【解析】
试题分析:(1)A、反应前后气体系数之和相等,反应始终压强都相等,不能作为达到平衡的标志,故错误;B、依据化学平衡状态的定义:一定条件下,可逆反应中,当正方向速率和逆反应速率相等,且各组分的浓度不变,这样的状态的成为化学平衡状态,故正确;C、1 mol H-H键断裂同时2 mol H-O键形成 ,都是向正反应方向进行的,不能作为达到平衡的标志,故错误;D、反应向正反应方向进行,Na2S的质量不断增大,当质量不在改变,说明达到平衡了,故正确;E、依据化学平衡状态的定义,故说法正确;F、ρ=m/v,随反应的进行,气体的质量增加,且此容器是恒容,当密度不在改变,说明达到平衡,故正确;(2)气体质量增加8g,消耗氢气4×8/64mol=0.5mol,v(H2)=0.5/(2×2)mol/(L·min)=0.125 mol/(L·min);(3)依据原电池的工作原理,化合价升高的电极作负极,即通入燃料的电极为负极,电极反应式:C3H8+26OH--20e-=3CO32-+17H2O,正极反应:O2+4e-+2H2O=4OH-;(4)燃料电池优点:能量转化率高,环境友好;(5)根据C3H8+26OH--20e-=3CO32-+17H2O,生成0.1molK2CO3,同时消耗丙烷0.1×22.4×103/3mL=746.7mL。


科目:高中化学 来源: 题型:
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
A.Zn为电池的负极
B.正极反应式为2FeO42﹣+10H++6e﹣=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH﹣向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
D. 若用NaCl溶液代替盐酸,则电池总反应随之改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于氧化还原反应且水既不作氧化剂又不作还原剂的是( )
A. CaO+H2O=Ca(OH)2
B. NaH+H2O=NaOH+H2↑
C. 3NO2+H2O=2HNO3+NO
D. 2H2O+2F2=4HF+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内杂质,下列有关试剂和操作方法不正确的是
A. 溴苯(苯):蒸馏 B. 乙醇(乙酸): KOH溶液,分液
C. 乙烷(乙烯):溴水,洗气 D. 苯(溴单质):稀NaOH溶液,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用 ( )
A.H2O2溶液 B.KMnO4溶液
C.氯水 D.HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止月饼等富含油脂食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,下列不属于抗氧化物质的是( )
A.维生素C
B.还原铁粉
C.亚硫酸钠
D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.请根据化学反应与热能的有关知识,填写下列空白:
(1)下列反应中,属于吸热反应的是_________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③铝粉与氧化铁粉末在高温下反应
④酸碱中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)已知H2和O2反应放热,且断开1molH-H、1mo1O=O、1molO-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ,由此可以推知下列关系正确的是______(填字母编号)。
A. Q1+ Q2> Q3 B. 2Q1+ Q2<4 Q3 C. Q1+Q2>2Q3 D. 2Q1+Q2<2Q3
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和______(填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量_______(填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式:____________________________________。
(6)观察下图,计算1molH2与1molCl2反应_______(“吸收”或“释放”)的能量为_________。
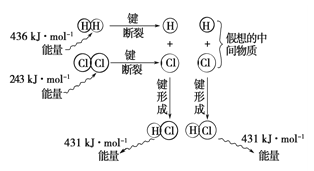
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com