
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B ②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则另二种酸对应的电离常数分别为(根据已知数据填
空):HA的Ka= ,HC的Ka= 。
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、
HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质
为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。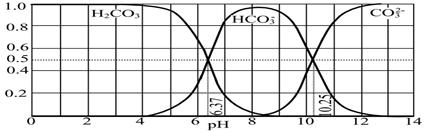
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10 mL 0.02 mol·L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100 mL,向该溶液中加入1 mL 1×10-4 mol·L-1的CaCl2溶液,问是否有沉淀生成? (填“是”或“否”)。
(1)HA的Ka=1.8×10-5(1分)、 HC的Ka=4.9×10-10(1分)
(2)NaHR(2分)
(3) ① C、D(2分) ② 否(2分)
解析试题分析:(1)由①得出酸性HA强于H2B;由②得H2B强于HC;由③得HA强于HC;HA最强平衡常数最大;(2)该关系式为NaHR的物料守恒;(3)①A、图开始为H2CO3,无碳酸根离子,错误;B、在pH分别为6.37 时c(H2CO3)=c(HCO3-), pH为10.25时,溶液中c(HCO3-)=c(CO32-),错误;C、正确;D、图像中显示pH为7~9之间溶液主要以HCO3-为主,正确;②此时溶液中c(CO32-)=0.02×0.01÷0.1×0.5=0.001mol/L,c(Ca2+)=1×10-4÷100=10-6 mol/L,Q=10-6×0.001=10-9<5.0×10-9,故没有沉淀生成。
考点:考查电离平衡、水解平衡、沉淀溶解平衡有关问题。


科目:高中化学 来源: 题型:填空题
水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。
请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的
c(OH-)=________ mol·L-1。
(2)25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为__________,由水电离出的c(OH-)=__________ mol·L-1。
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是__________________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42—。该溶液中c(H+)_________________________c(OH-)+c(SO42—)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: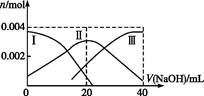
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
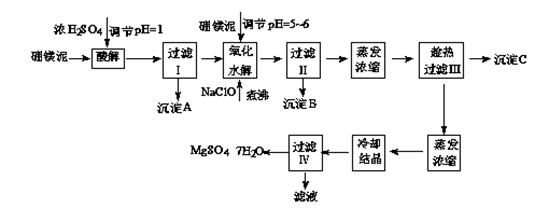
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
结合下表回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com