
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
(1)碱性 A2-+H2O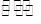 HA-+OH-;(2)<(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
HA-+OH-;(2)<(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
解析试题分析:(1)Na2A是强碱弱酸可盐,水解显碱性,方程式如下: A2-+H2O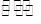 HA-+OH-;
HA-+OH-;
(2)0.1 mol·L-1 NaHA溶液的pH=2,表明由HA-所电离出的氢离子的浓度为0.01mol/L,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度为:
H2A = H+ + HA-,
起始:0.1 mol·L-1 0 0
电离后:0 0.1 mol·L-1 0.1 mol·L-1
HA-  H+ + A2-
H+ + A2-
0.1 mol·L-1 0 0
若按照NaHA溶液中的电离情况,溶液中的氢离子浓度为:0.01 mol·L-1,但是受第一步电离的影响,第一步生成的氢离子对第二步产生了抑制作用,因此第二步的电离比在NaHA溶液中的电离情况要弱一点,所以有0.1 mol·L-1 H2A溶液中H+的物质的量浓度<0.11 mol·L-1。
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
考点:考查强弱电解质的电离。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:填空题
SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为V L的硫酸工业尾气中SO2的含量。
过量H2O2溶液步骤①过量Ba(OH)2溶液步骤②步骤③
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为____________________,1 mol H2O2参加反应,转移的电子数为________。
(2)步骤③的操作依次是过滤、________、________、称重。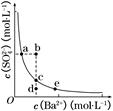
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为________(填序号)。
①d→c→e ②b→c→d ③a→c→e ④d→c→a
(4)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH: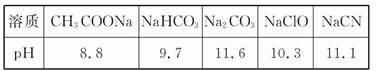
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是 (填编号);其pH为 (填数值);pH最大的是 (填编号)。
①CH3COOH ②HCN ③HClO ④H2SO4 ⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律: ;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B ②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则另二种酸对应的电离常数分别为(根据已知数据填
空):HA的Ka= ,HC的Ka= 。
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、
HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质
为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。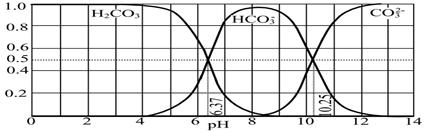
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10 mL 0.02 mol·L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100 mL,向该溶液中加入1 mL 1×10-4 mol·L-1的CaCl2溶液,问是否有沉淀生成? (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
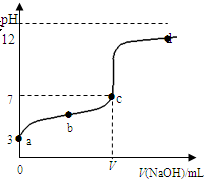
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的 特性,使之能与钠离子充分接触。
(2)水电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池的负极反应式为 。水电池工作时,Na+不断向 极方向移动。
(3)水电池生成1 mol Na2Mn5O10转移电子的物质的量为 。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如右图。请据右图分析: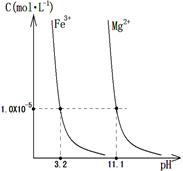
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回答下列问题。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
①不能证明HA是弱电解质的方法是( )
A.测得0. 1mol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
②混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)>c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.c( HA) +c( H+)=c(OH-)
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则相同pH的①NaA溶液;②Na2B溶液;③NaHB溶液;④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 mol/L。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)=0.02 mol/L。
①若HA为CH3COOH,二者等体积混合后该溶液显酸性,则溶液中所有离子按浓度由大到小排列的顺序是 。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 _ _ mol/L(假设混合后溶液体积为两溶液体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定温度下,有盐酸、硫酸、醋酸三种溶液,请按要求回答下列问题:
(1)当三种酸的物质的量浓度相同时,电离出来的c(H+)最大的是__________。
(2)若三者电离出来的c(H+)相同时,三种酸的物质的量浓度最小的是________。
(3)pH相同、体积相同的醋酸溶液和盐酸分别与足量的锌反应,刚开始反应时的反应速率的大小关系为______(填“相等”或者“不等”),相同状况下产生氢气的体积最大的酸是______。pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是:m n(填“>”、“=”、“<”)
(4)同体积、同物质的量浓度的醋酸和盐酸两种酸,分别中和同浓度的NaOH溶液,消耗NaOH的体积大小关系为 (填“相等”或者“不等”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com