
在一定温度下,有盐酸、硫酸、醋酸三种溶液,请按要求回答下列问题:
(1)当三种酸的物质的量浓度相同时,电离出来的c(H+)最大的是__________。
(2)若三者电离出来的c(H+)相同时,三种酸的物质的量浓度最小的是________。
(3)pH相同、体积相同的醋酸溶液和盐酸分别与足量的锌反应,刚开始反应时的反应速率的大小关系为______(填“相等”或者“不等”),相同状况下产生氢气的体积最大的酸是______。pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是:m n(填“>”、“=”、“<”)
(4)同体积、同物质的量浓度的醋酸和盐酸两种酸,分别中和同浓度的NaOH溶液,消耗NaOH的体积大小关系为 (填“相等”或者“不等”)
(1)H2SO4(硫酸) (2) H2SO4(硫酸) (3)相等、CH3COOH(醋酸)、> (4)相等
解析试题分析:(1)当三种酸的物质的量浓度相同时,由于盐酸和硫酸是强酸,完全电离,硫酸又是二元酸,而醋酸是弱酸,不完全电离,所以c(H+)最大的是硫酸。(2)三者电离出来的c(H+)相同时,因为醋酸为弱酸,其物质的量浓度远大于溶液中c(H+),而盐酸是一元强酸,硫酸是二元强酸,所以三者的物质的量浓度大小顺序为:c(CH3COOH)>c(HCl)>c(H2SO4),硫酸物质的量浓度最小。(3)pH相同则氢离子浓度相等,所以刚开始反应时的反应速率相等;因为醋酸是弱酸,加水稀释促进电离,稀释相同倍数时H+浓度比盐酸中H+浓度大,只有稀释倍数越大,才能使其和盐酸稀释后的H+浓度相同即pH仍相等,故m>n。(4)醋酸和盐酸的体积、物质的量均相等时,其溶质的物质的量也相等,能中和的NaOH的物质的量也相等,而NaOH溶液的浓度相同,故消耗的NaOH溶液的体积相等。
考点:考查弱电解质的电离平衡和溶液的稀释。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: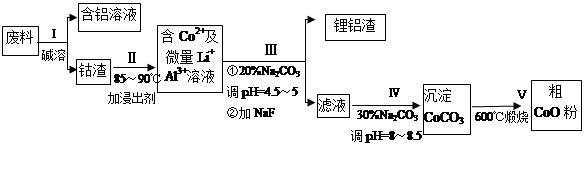
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________ ____________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是___ ___(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
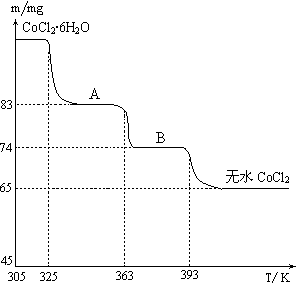
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
结合下表回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: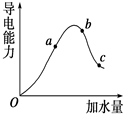
(1) “O”点为什么不导电________.
(2)a,b,c三点的pH由小到大的顺序是____________.
(3) a、b、c三点中电离程度最大的是
电离平衡常数Ka、Kb、Kc的大小关系为________.
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).
A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
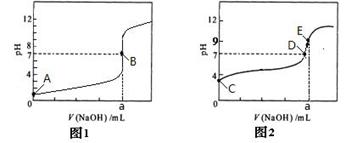
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示: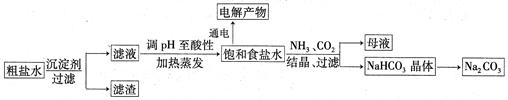
(1)为除去粗盐中的Ca2+、Mg2+和SO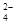 ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:
| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
 (OH-)的比值是_________。
(OH-)的比值是_________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(1)Fe2O3与H2SO4反应的离子方程式是_________________________________。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有__________________。
(3)加Fe的作用是_________________________________。
方法2:TiCl4水解生成TiO2·x H2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: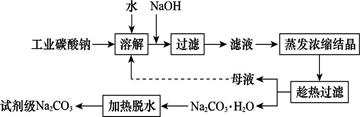
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com