
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
(1)HY (1分)
(2)HZ +OH- → H2O + Z-(2分), 1×10-5(2分)
(3)≧7(2分)
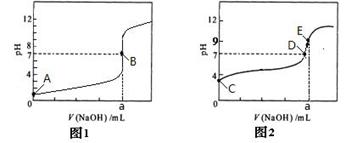
(4)①图1(1分) ②BD,B E(各1分,共2分)
③c(Na+) > c(Z-) > c(OH-) > c(H+)(2分)
解析试题分析:(1)乙选项中由PH=7可以判断出溶液呈中性,也就是说生成的盐是强酸强碱盐,故HY为强酸;
(2)由PH=9说明生成强碱弱酸盐,所以组实验发生反应的离子方程式为HZ +OH- → H2O + Z-,HZ为弱酸要写成化学式不能拆。由PH=9可知H+浓度为10-9,由于一部分氢离子和弱酸根离子结合了,故剩余的H+为10-9,则由水电离出的 OH-为10-5mol/L;
(3)HX若是强酸则PH=7,若是弱酸,则PH.>7;
(4)乙组溶液呈中性,故为图1;表示溶液恰好完全反应的点有B,D, E,完全反应溶液不一定呈中性;由于是等体积混合,由图中可知PH>7说明混合后呈碱性,可知溶液中离子的关系为c(Na+) > c(Z-) > c(OH-) > c(H+)。
考点:考查盐类的水解和离子浓度大小的判断。


科目:高中化学 来源: 题型:填空题
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的 特性,使之能与钠离子充分接触。
(2)水电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池的负极反应式为 。水电池工作时,Na+不断向 极方向移动。
(3)水电池生成1 mol Na2Mn5O10转移电子的物质的量为 。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如右图。请据右图分析: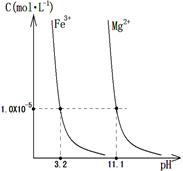
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A. |
B.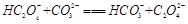 |
C.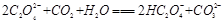 |
D.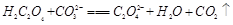 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: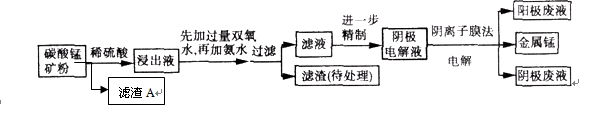
阴离子膜法电解装置如下图所示: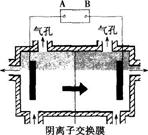
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg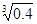 = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定温度下,有盐酸、硫酸、醋酸三种溶液,请按要求回答下列问题:
(1)当三种酸的物质的量浓度相同时,电离出来的c(H+)最大的是__________。
(2)若三者电离出来的c(H+)相同时,三种酸的物质的量浓度最小的是________。
(3)pH相同、体积相同的醋酸溶液和盐酸分别与足量的锌反应,刚开始反应时的反应速率的大小关系为______(填“相等”或者“不等”),相同状况下产生氢气的体积最大的酸是______。pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是:m n(填“>”、“=”、“<”)
(4)同体积、同物质的量浓度的醋酸和盐酸两种酸,分别中和同浓度的NaOH溶液,消耗NaOH的体积大小关系为 (填“相等”或者“不等”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后
溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因: (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) (填“>”“<”或“=”)0.1 mol/L NaOH
溶液中由水电离出的c(H+)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= mol/L,
c(OH-)-c(HA) = mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3
溶液的pH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四
种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下: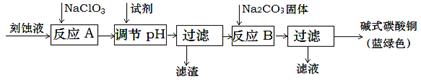
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)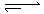 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是_ (用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下: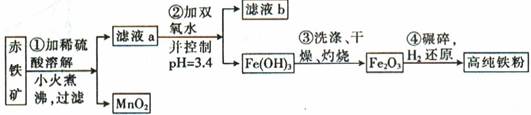
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 ,已知25℃时,Ksp[Cu(OH)2] =2.0 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净? 。
(5)制备氮化铁磁粉的反应:Fe+NH3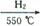 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com