
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后
溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因: (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) (填“>”“<”或“=”)0.1 mol/L NaOH
溶液中由水电离出的c(H+)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= mol/L,
c(OH-)-c(HA) = mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3
溶液的pH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四
种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
(1) A-+H2O?HA+OH- (2)> (3) 9.9×10-7 10-8 (4)大于 A>B>D>C
解析试题分析:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸, 生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O?HA+OH-,故答案为:A-+H2O?HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol?L-1NaOH溶液中由水电离出的c(H+),
故答案为:>;
(3)由电荷守恒可知,c(Na+)-c(A-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol/L,故答案为: 9.9×10-7;
0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合生成NaA溶液;测得混合溶液的pH=8,c(H+)=10-8mol/L;溶液显碱性,说明A-离子水解,溶液中存在质子守恒:c(OH-)=c(H+)+c(HA),则c(OH-)-c(HA)=c(H+)=10-8mol/L;
故答案为:10-8;
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性, 说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;
(NH4)2SO4和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大, 水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;
NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;
NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH 值最大,则pH大小顺序为A>B>D>C,
故答案为:大于;A>B>D>C.
考点:酸碱混合时的定性判断及有关ph的计算


科目:高中化学 来源: 题型:填空题
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。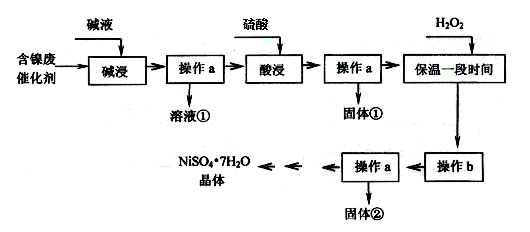
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
 2Ni(OH)2,写出该反应放电时正极反应式 。
2Ni(OH)2,写出该反应放电时正极反应式 。 。
。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
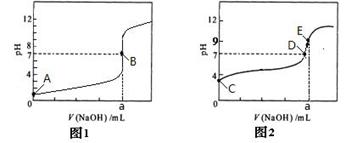
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | c(一元酸) | c(NaOH) /mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | 0.1 | pH = x |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | 0.1 | pH = 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法: 。
(3)乙方案中,说明HA是弱电解质的现象是
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
高氯酸铵样品中 NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
步骤 1:按如图所示组装仪器,检查装置气密性。
步骤 2:准确称取样品a g (约 0.5 g)于蒸馏烧瓶中,加入约 150 mL 水溶解。
步骤 3:准确量取 40.00 mL 约 0.1 mol·L-1 H2SO4溶液于锥形瓶中。
步骤 4:经滴液漏斗向蒸馏烧瓶中加入 20 mL 3 mol·L-1NaOH 溶液。
步骤 5:加热蒸馏至蒸馏烧瓶中剩余约 100 mL 溶液。
步骤 6:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 7:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,消耗 NaOH 标准溶液 V1 mL。
步骤 8:将实验步骤 1~7 重复 2 次。
①步骤 3中,准确量取 40.00 mL H2SO4溶液的玻璃仪器是 。
②步骤 1~7 中,确保生成的氨被稀硫酸完全吸收的实验步骤是 (填步骤序号)。
③为获得样品中 NH4ClO4的含量,还需补充的实验是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com