
(1)��֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1 mol/L������5����Һ��pH: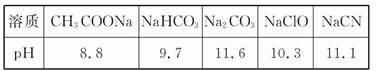
����������Ϣ�жϣ�Ũ�Ⱦ�Ϊ0.05 mol/L������5�����ʵ���Һ�У�pH��С���� (����);��pHΪ (����ֵ)��pH������ (����)��
��CH3COOH ��HCN ��HClO ��H2SO4 ��HClO4
(2)����ת�������ڸ��ֽⷴӦ��
�ٹ�ҵ�Ͻ�ʯ�����봿����Һ��Ͽ��Ƶÿ�������Һ��
���ں����Ƽ�У���̼�������Һ�м��뱥��ʳ��ˮ�ɻ��С�մ��塣
������KCl��NaNO3�����Һ����������NaCl���塣
����������Ӧ���ܽ�����ֽⷴӦ������һ�����ɣ� ��
��KI��Һ��AgCl�����Ͻ��裬��۲쵽�������� ,
��д����Ӧ�����ӷ���ʽ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�±��Dz�ͬ�¶���ˮ�����ӻ������ݣ�
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ� | 1��10��14 | a | 1��10��12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���С������г��漰�ơ����仯���
(1)ʵ���ҿ�����ˮ�Ҵ��������������Ľ����ƣ���ѧ��Ӧ����ʽΪ ��Ҫ��ϴ�������Թܱ��ϵ����õ��Լ��� ��
(2)��ͼΪ�Ƹ��ܵ�صĽṹʾ��ͼ���õ�صĹ����¶�Ϊ320 �����ң���ط�ӦΪ2Na+xS=Na2Sx,�����ĵ缫��ӦʽΪ ��M(��Na2O��Al2O3�Ƶ�)������������ ��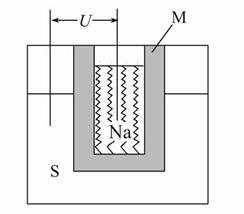
��Ǧ������ȣ���������ͬ�����ĸ�����������ʱ�������ص����۷ŵ�����Ǧ���ص� __ ����
(3)Na2S��Һ������Ũ���ɴ�С��˳��Ϊ �������Һ�м�����������CuSO4����ҺpH (���������С�����䡱)��Na2S��Һ���ڷ�������������ԭ��Ϊ (�����ӷ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)pH��13��CH3COONa��Һ��ˮϡ��100����pH________11(�>����������<��)ԭ����______________________________________________(�����ӷ���ʽ�ͱ�Ҫ������˵��)��pH��ȵ�NaOH��Һ��CH3COONa��Һ���ֱ���ȵ���ͬ���¶Ⱥ�CH3COONa��Һ��pH________NaOH��Һ��pH(�>����������<��)��
(2)pH���ʱ����NH4Cl����(NH4)2SO4����NH4HSO4������Һ��c(NH4+)�ɴ�С��˳��Ϊ________��
(3)���������Ũ�ȵ���������������Ϻ���Һ��________�ԣ���Һ��c(Na��)________c(CH3COO��)(�>����������<��)��pH��13������������pH��1�Ĵ���������Ϻ���Һ��________�ԣ���Һ��c(Na��)________c(CH3COO��)(�>����������<��)��
(4)�����ʵ���Ũ����ͬ�������백ˮ��Ϻ���Һ�е�c(NH4+)��c(Cl��)�����Ϻ���Һ��________�ԣ���������________��ˮ�����(�>����������<��)��
(5)NaHSO4��ˮ�еĵ��뷽��ʽΪNaHSO4=Na����H����SO42��������Һ��c(H��)_________________________c(OH��)��c(SO42��)(�>����������<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
pC����pH,��ָ��ϡ��Һ��,�������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol��L-1,�����Һ�����ʵ�pC=-lg(1��10-3)=3����ͼΪ,H2CO3�ڼ���ǿ���ǿ����Һ��,ƽ��ʱ��Һ�����ֳɷֵ�pC��pHͼ����ش���������: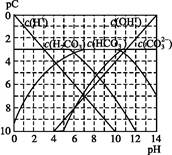
(1)������ѪҺ��,HC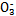 ����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����������ѪҺ��,HC ��ˮ��̶�������������̶�(�<����>����=��)��
��ˮ��̶�������������̶�(�<����>����=��)��
��pH=7.00��ѪҺ��,c(H2CO3)��������c(HC )(�<����>����=��)��
)(�<����>����=��)��
(2)H2CO3һ������ƽ�ⳣ������ֵ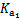 ������������
������������
(3)ijͬѧ��Ϊ����Һ��Na2CO3��ˮ��������,����ˮ���C ��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
����
(4)��֪ij�¶���Li2CO3��KspΪ1.68��10-3,������Li2CO3��������100 mLˮ�����պñ���,����Li2CO3��Һ��c(Li+)="0.15" mol��L-1��c(C )="0.075" mol��L-1����t1ʱ����������ϵ�м���100 mL 0.125 mol��L-1 Na2CO3��Һ,��ʽ����˵���Ƿ��г���������
)="0.075" mol��L-1����t1ʱ����������ϵ�м���100 mL 0.125 mol��L-1 Na2CO3��Һ,��ʽ����˵���Ƿ��г���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Դ�����п�ۣ���FeO��Fe2O3��ZnS�ȣ���ȡ����ZnO�Ĺ������£�
����1����H2SO4����������п��ͬʱ����H2O2��
����2�����ˣ�������Һ��pH��
����3�����ˣ�����Һ�м�NH4HCO3���ü�ʽ̼��п������
����4�����ˡ�ϴ�ӡ����գ��ò�Ʒ��
��֪�����ӳ�����pH���±���
| ���� | ��ʼ����pH | ������ȫpH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��.��֪:H2A��A2-�ɱ�ʾS2-��S ��S
��S ��Si
��Si ��C
��C �����ӡ�
�����ӡ�
(1)������,��20 mL 0.2 mol��L-1 H2A��Һ�еμ�0.2 mol��L-1 NaOH��Һ���й������ʵ����仯��ͼ(���Т����H2A,�����HA-,�����A2-)�������ͼʾ���: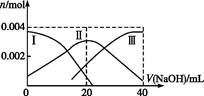
�ٵ�V(NaOH)="20" mLʱ,��Һ������Ũ�ȴ�С��ϵ:��������������������������
�ڵ������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�,����Һ��ˮ�ĵ���̶ȱȴ�ˮ��������(���С������ȡ�),��ʹNaHA��Һ������,���������м�������������
(2)��H2AΪ����:t��ʱ,��pH=2��ϡ�����pH=11��NaOH��Һ�������Ϻ���Һ������,����¶���ˮ�����ӻ�����KW=����������
��.��֪:��25 ��ʱ��H2O H++OH-��KW=10-14
H++OH-��KW=10-14
CH3COOH H++CH3COO-��Ka=1.8��10-5
H++CH3COO-��Ka=1.8��10-5
(3)������ˮ���ƽ�ⳣ��Kh�ı���ʽΪ��������,������ֵ=��������,�������¶�ʱ,Kh����������(�������С�����䡱)��
(4)0.5 mol��L-1��������ҺpHΪm,��ˮ��ij̶�(��ˮ��Ĵ�������ԭ�д����Ƶı�ֵ)Ϊa;1 mol��L-1��������ҺpHΪn,ˮ��ij̶�Ϊb,��m��n�Ĺ�ϵΪ��������,a��b�Ĺ�ϵΪ����������(����ڡ���С�ڡ����ڡ�)
��.(5)25 ��ʱ,��a mol��L-1�İ�ˮ��b mol��L-1�����������,��Ӧ����Һǡ��������,��a b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������
b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ��Һ�еĵ��뷽��ʽ�ǣ�
H2A=H����HA����HA�� H����A2����
H����A2����
�Իش��������⣺
��1��Na2A��Һ��________(����ԡ��������ԡ����ԡ�)��������_____________________(�����ӷ���ʽ��ʾ)��
��2����0.1 mol��L��1 NaHA��Һ��pH��2����0.1 mol��L��1 H2A��Һ��H�������ʵ���Ũ��________0.11 mol��L��1��(���������������<��)
��3��0.1 mol��L��1 NaHA��Һ�и�������Ũ���ɴ�С��˳����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ�ֺ�����ﮡ��ܵ����͵��Ӳ��ϣ������в����ķ��������ɹۣ������е����Խ�����������ʽ���ڣ�����Co2O3��CoO����ʽ���ڣ������������ĵ����˫�棻﮻��������С�
�ӷ����л��������ܣ�CoO���Ĺ����������£�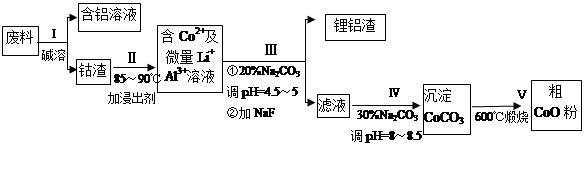
��1������I�в���NaOH��Һ�ܳ������е�Al����Ӧ�����ӷ���ʽΪ ��
��2�����̢�õ����������Ҫ�ɷ���LiF��Al(OH)3��̼������Һ�ڲ���Al(OH)3ʱ����Ҫ���ã���д���÷�Ӧ�����ӷ���ʽ________ ____________��
��3��̼������Һ�ڹ���III��IV����������������ͬ����д���ڹ���IV����������� ��
��4����Na2CO3��Һ�д��ڶ������ӣ����и�����Ũ�ȹ�ϵ��ȷ����___ ___������ţ���
| A��c(Na+) = 2c(CO32-) |
| B��c(Na+) > c(HCO3-) > c(CO32-) |
| C��c(OH-) > c(HCO3-) > c(H+) |
| D��c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com