
回答下列问题。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
(1)<,(1分) Fe3+发生水解,加入盐酸后,抑制其水解。(2分)
FeCl3+3H2O Fe(OH)3+3HCl 或FeCl3+3H2O
Fe(OH)3+3HCl 或FeCl3+3H2O Fe(OH)3↓+3HCl ↑( 2分 )
Fe(OH)3↓+3HCl ↑( 2分 )
2Fe(OH)3 Fe2O3+3H2O (2分)
Fe2O3+3H2O (2分)
(2)氨水中存在电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分)
NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,使氨水的电离平衡向左移动,溶液中c(OH-)减小。(3分)
(3)① 醋酸钠 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) (每空1分,共2)
②NaOH、CH3COONa (2分) ③中性,< (每空1分,共2分))
解析试题分析:(1)氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,因此常温时,FeCl3溶液的pH<7;氯化铁是强酸弱碱盐,溶于水铁离子水解溶液显酸性,加入盐酸后,抑制铁离子水解;水解是吸热的,加热促进水解。且生成的氯化氢极易挥发,因此最终得到氢氧化铁固体,进一步灼烧得到氧化铁,反应的反应式有FeCl3+3H2O Fe(OH)3+3HCl或FeCl3+3H2O
Fe(OH)3+3HCl或FeCl3+3H2O Fe(OH)3↓+3HCl↑、2Fe(OH)3
Fe(OH)3↓+3HCl↑、2Fe(OH)3 Fe2O3+3H2O。
Fe2O3+3H2O。
(2)氨水中存在一水合氨的电离平衡NH3·H2O NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。
NH4+ + OH-。NH4Cl溶于水,发生电离NH4Cl=NH4++Cl-,产生大量NH4+,增大溶液中c(NH4+)浓度,使一水合氨的电离平衡向左移动,因此溶液中c(OH-)减小。
(3)①只有醋酸钠能同时电离出Na+、CH3COO-,而任何溶液中都存在水的电离平衡,所以若溶液中只溶解了一种溶质,该溶质的名称是醋酸钠。醋酸钠溶于水电离出的CH3COO-水解溶液显碱性,所以溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
②由于醋酸钠的水解程度比较小,所以若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),这说明溶液是由醋酸钠和氢氧化钠组成的混合液,则溶液中溶质的化学式NaOH、CH3COONa。
③根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以若溶液中c(Na+)=c(CH3COO-),则溶液中c(OH-)=(H+),所以该溶液显中性。如果醋酸和氢氧化钠恰好中和生成醋酸钠,由于醋酸钠水解溶液显碱性。因此要使溶液显中性,则醋酸一定是过量的。因此若该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH)< c(CH3COOH)。
考点:考查水解平衡的应用、外界条件对水解平衡的影响以及溶液中离子浓度大小比较


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。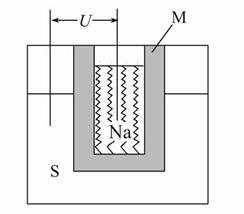
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: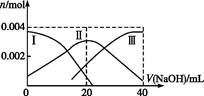
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A=H++HA-,HA- H++A2-。
H++A2-。
试回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是_____________________(用离子方程式表示)。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中H+的物质的量浓度________0.11 mol·L-1。(填“>”、“=”或“<”)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
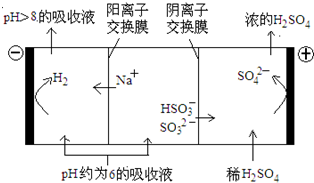
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
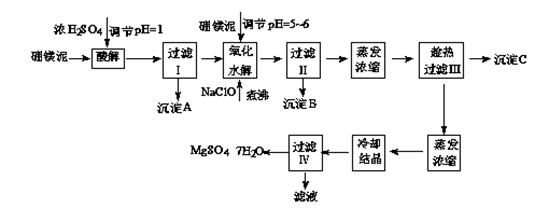
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: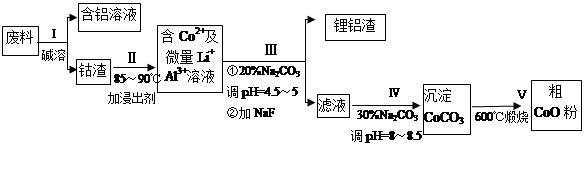
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________ ____________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是___ ___(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示: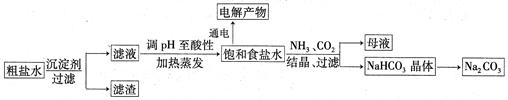
(1)为除去粗盐中的Ca2+、Mg2+和SO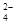 ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:
| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
 (OH-)的比值是_________。
(OH-)的比值是_________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com