
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
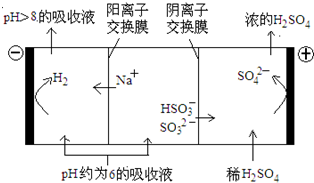
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
| n(SO32��):n(HSO3��) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
��1��SO32����SO2��H2O��2HSO3����1�֣�
��2��BC��2�֣�ȫ�Ե�2�֣��д����÷֣�ѡ��ȫ��1�֣�
��3�����ᣨ1�֣�����������������Һ��HSO3�����ڵ���ƽ�⣺HSO3�� SO32����H����ˮ��ƽ��HSO3����H2O
SO32����H����ˮ��ƽ��HSO3����H2O H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԣ�2�֣���A��1�֣�
H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԣ�2�֣���A��1�֣�
��4����HSO3����H2O��2e����SO42����3H����2�֣���1g��1�֣�
���������������1���������Ƕ�Ԫ���ᣬ������������SO2ת��Ϊ��ʽ�Σ������Ƽ�ѭ�����У�����ҺΪNa2SO3��Һʱ��Ӧ�����ӷ���ʽΪSO32����SO2��H2O��2HSO3����
��2������ĵ��볣��Խ������Խǿ�������H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11��֪������ǿ��˳����H2SO3��H2CO3��HSO3����HCO3�������ݽ�ǿ�����Ʊ����������֪��CO32����HSO3����Ӧ����HCO3����SO32�������ܴ������棻H2SO3��HCO3����Ӧ����CO2��HSO3�������ܴ������档��HCO3����HSO3����SO32����HCO3�������Դ������棬��ѡBC��
��3��������SO32��ֻ��ˮ�⣬��Һ�Լ��ԣ����Ը���n(SO32��):n(HSO3��)��1:91ʱ��Һ�����Կ�֪��NaHSO3��Һ�����ԡ�����������������������Һ��HSO3�����ڵ���ƽ�⣺HSO3�� SO32����H����ˮ��ƽ��HSO3����H2O
SO32����H����ˮ��ƽ��HSO3����H2O H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�
H2SO3��OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�
�ڸ��������غ��֪��c(Na+)��c(SO32-)+c(HSO3-)+ c(H2SO3)��A����ȷ��B������HSO3���ĵ���̶�ǿ��ˮ��̶ȣ��Ҿ��Ǻ����ģ�������Һ��c(Na+)��c(HSO3-)��c(H+)��c(SO32-)��c(OH-)��B��ȷ��C�����ݵ���غ��֪c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)�������غ��֪c(Na+)��c(SO32-)+c(HSO3-)+ c(H2SO3)����Һ��c(H2SO3)+ c(H+)��c(SO32-)+c(OH-)��C��ȷ��D�����ϵ���غ�c(Na+)+ c(H+)��2c(SO32-)+ c(HSO3-)+ c(OH-)��D��ȷ����ѡA��
��4���ٵ������������Դ������������ʧȥ���ӣ�����������Ӧ������װ�ÿ�֪�������������ɣ�������Һ��pH��6����Һ����Ҫ����HSO3-���ڣ�����������Ҫ��HSO3-�ŵ磬��������Ϸ����ĵ缫��ӦʽΪHSO3����H2O��2e����SO42����3H����
�ڵ����������õ����裬�����װ�ÿ��ж���������Һ�е������ӷŵ������������缫��ӦʽΪ2H����2e����H2�������缫����1mol����ת��ʱ�����õ�0.5mol�����������������������Ϊ0.5mol��2g/mol��1g��
���㣺�����������ε����ʡ�����ˮ�⡢������ʵĵ��롢���볣����Ӧ�á���Һ������Ũ�ȴ�С�Ƚ��Լ��绯ѧԭ����Ӧ�������


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪25 ��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ��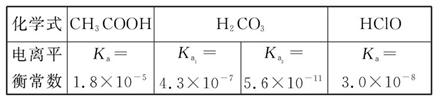
�ش��������⣺
(1)���ʵ���Ũ�Ⱦ�Ϊ0.1 mol��L-1��������Һ��
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH��С��������˳���� (�ñ����д)��
(2)�����£�0.1 mol/L��CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ����� ��
| A��c(H+) |
| B��c(H+)/c(CH3COOH) |
| C��c(H+)��c(OH-) |
| D��c(OH-)/c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
)2013��ȫ�������������������ص����������������ǵij��м���������˼����Σ��������о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
I������������Ч����SO2�Կ�������Ⱦ��
��1����ˮ�������ԣ���Ҫ����Na+��K+��Ca2+��Mg2+��CI-��SO42-��Br-��HCO3-�����ӡ���SO2�����������ú�ˮ�����乤����������ͼ��ʾ��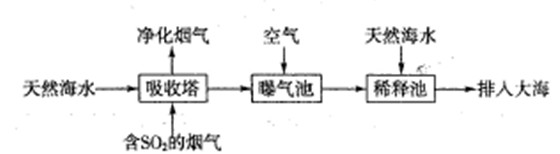
������������ͨ�������Ŀ����
��ͨ��������������к�ˮ����Ȼ��ˮ��ȣ�Ũ��û�����Ա仯�������� ��
a��Cl- B��SO42- C��HCO3-
��2����NaOH��Һ���������е�SO2�������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ��(�缫����Ϊʯī)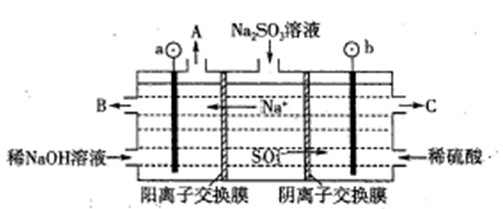
��ͼ��b��Ҫ���ӵ��(���������) ����C�������������� ��
��SO32-�ŵ�ĵ缫��ӦʽΪ
�۵�����������������������ǿ����ƽ���ƶ�ԭ������ԭ�� ��
II���ҹ��������ѽṹ��ȼúΪ������ú�����ɼ��ٻ�����Ⱦ����ú�����������ܲ����к�����H2S����������Na2CO3��Һ�����գ��÷�Ӧ�����ӷ���ʽΪ ��
(��֪��H2S Kal=9��1��10-8��Ka2=1��1 ��10-12��H2CO3 Kal=4��30��10-7��Ka2=5��61 ��10-11)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ڳ�������20mL 0.1 mol��L��1ij�ᣨ��HAc��ʾ����Һ����μ���0.1 mol��L��1 NaOH��Һ����pH�����ⶨ��Һ��pH�������±�������pH��NaOH��Һ�����ϵ��������ͼ��ʾ�������¶ȱ仯��������ݱ������ݺ͵ζ����ش��������⣺
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
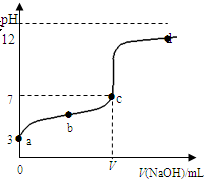
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ijѧ����0.10 mol/L��NaOH��Һ�ζ�ijŨ�ȵ����ᡣ��¼�������£�
| ʵ����� | ����Һ�����mL�� | ������NaOH��Һ�������mL�� | |
| �ζ�ǰ | �ζ��� | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ش��������⡣
��1������ʱ��FeCl3��Һ��pH 7�����������������������ʵ��������FeCl3��Һʱ����FeCl3���������ڽ�Ũ��������Һ�У�Ȼ����������ˮϡ�͵������Ũ�ȣ�ԭ���� ����FeCl3��Һ���ɡ����գ��˹��������漰���Ļ�ѧ����ʽ�� ��
��2��25��ʱ����0.1 mol��L��1��ˮ�м�������NH4Cl���壬�������ܽ�����ҺpH��С����Ҫԭ���� ��
��3��ij��Һ��ֻ����OH����H+��Na+��CH3COO���������ӡ�
������Һ��ֻ�ܽ���һ�����ʣ������ʵ������� ������Һ���������ӵ�Ũ���ɴ�С��˳��Ϊ ��
������Һ���������ӵĴ�С˳��Ϊc��Na+����c��OH������c��CH3COO������c��H+��������Һ�����ʵĻ�ѧʽΪ ��
������Һ��c��Na+����c��CH3COO�����������Һ�� ������ԡ��������ԡ��������ԡ���������Һ�������ȵ�ϡNaOH��CH3COOH��Һ��϶��ɣ�����ǰc��NaOH�� c��CH3COOH�������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ʊ�пӡˢ��·������ϡ���ḯʴп�壬�����ķ�Һ�ơ��ð�Һ�������ð�Һ���к�����п�⣬����������ˮ�����Cl����Fe3+����ʵ������á��ð�Һ����ȡZnSO4��7H2O�Ĺ������£�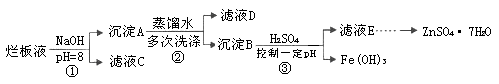
��1����ϡ���ḯʴп��ʱ��ԭ����ΪN2O���������뻹ԭ�������ʵ���֮���� ��
��2��������ٵ�pH>12����Zn(OH)2�ܽ��������ǻ���п���ơ�д��Zn(OH)2���ܽ�����ӷ���ʽ ��
��3����ҺD�г��˺���OH�������⣬�����е��������� �������ӷ��ţ���
��4������ҺE��pH=4��c(Zn2+)=2mol��L-1��c(Fe3+)=2.6��l0-9mol��L-1������õ��ܶȻ��� ����ѡ���
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]��Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
��5�������Ҫ����pH��һ����Χ��ʵ������pH��ֽ�ⶨ��ҺpH�ķ����ǣ� ���� ��
��6����֪����Fe(OH)3(s) Fe3+(aq)+3OH-(aq) �� ��H=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) �� ��H=" a" kJ?mol-1
��H2O(l)  H+(aq)+OH-(aq) ����H=" b" kJ?mol-1
H+(aq)+OH-(aq) ����H=" b" kJ?mol-1
��д��Fe3+����ˮ�ⷴӦ���Ȼ�ѧ����ʽ�� ��
���ٵ��ܶȻ�����ΪKSP���ڵ����ӻ�����ΪKW��Fe3+����ˮ�ⷴӦ��ƽ�ⳣ����
K= �����ú�KSP��KW�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��
��1����������Ĥ��������ʳ��ˮʱ��Cl2����NaOH��ֽӴ������²������NaClO��H2����Ĥ��������ʳ��ˮ��Ӧ�����ӷ���ʽΪ ��
��2���ȼҵ���ܸߣ�һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խڣ��磩��30�����ϡ������ֹ�������У�������ϵĴ�����ת����ϵ����ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ����
�پ����Ƶı���NaCl��ҺӦ��ͼ�е��ص� ����д���� ���ҡ�����ע�롣
��ͼ��X��____ __���ѧʽ�����������ҵĵ缫��ӦʽΪ�� _ ��ͼʾ������������Һ��������a����b���Ĺ�ϵ�� ������ĸ����
A. a%=b% B. a%��b% C. a%��b%
�ۼ��е����ӽ���ĤΪ ��������ӽ���Ĥ���������ӽ���Ĥ������
��3���ȼҵ�IJ���NaOH�벻ͬ���ʷ�Ӧ�������ɲ�ͬ���Ρ���֪�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��4��������ҺpH���±���
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ˮ�����ؽ���Ǧ����Ⱦ���ⱸ�ܹ�ע��ˮ��Һ��Ǧ�Ĵ�����̬��Ҫ��Pb2����Pb(OH)����Pb(OH)2��Pb(OH)3-��Pb(OH)42-������̬��Ũ�ȷ���������ҺpH�仯�Ĺ�ϵ����ͼ��ʾ�� 
(1)Pb(NO3)2��Һ�У� ________2(�>����������<��)��������Һ�е����Ȼ����Һ��
________2(�>����������<��)��������Һ�е����Ȼ����Һ�� ���ӣ����ܵ�ԭ����________________________________��
���ӣ����ܵ�ԭ����________________________________��
(2)��Pb(NO3)2��Һ�е���ϡNaOH��Һ��pH��8ʱ��Һ�д��ڵ�������(Na������)��__________��pH��9ʱ��Ҫ��Ӧ�����ӷ���ʽΪ_______________________��
(3)ij�������Ʊ���һ��������Ǧ��������Чȥ��ˮ�еĺ���Ǧ��ʵ�������±���
| ���� | Pb2�� | Ca2�� | Fe3�� | Mn2�� | Cl�� |
| ����ǰŨ��/(mg��L��1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| ������Ũ��/(mg��L��1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
 E2Pb(s)��2H������Ǧ�������pH��ΧΪ( )
E2Pb(s)��2H������Ǧ�������pH��ΧΪ( )�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com