
)2013��ȫ�������������������ص����������������ǵij��м���������˼����Σ��������о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
I������������Ч����SO2�Կ�������Ⱦ��
��1����ˮ�������ԣ���Ҫ����Na+��K+��Ca2+��Mg2+��CI-��SO42-��Br-��HCO3-�����ӡ���SO2�����������ú�ˮ�����乤����������ͼ��ʾ��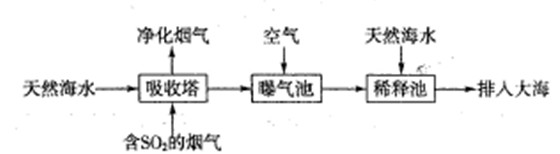
������������ͨ�������Ŀ����
��ͨ��������������к�ˮ����Ȼ��ˮ��ȣ�Ũ��û�����Ա仯�������� ��
a��Cl- B��SO42- C��HCO3-
��2����NaOH��Һ���������е�SO2�������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ��(�缫����Ϊʯī)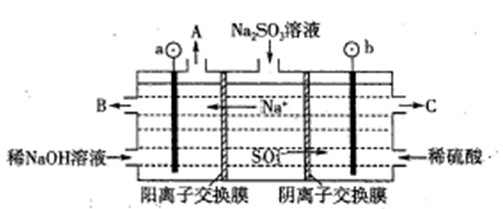
��ͼ��b��Ҫ���ӵ��(���������) ����C�������������� ��
��SO32-�ŵ�ĵ缫��ӦʽΪ
�۵�����������������������ǿ����ƽ���ƶ�ԭ������ԭ�� ��
II���ҹ��������ѽṹ��ȼúΪ������ú�����ɼ��ٻ�����Ⱦ����ú�����������ܲ����к�����H2S����������Na2CO3��Һ�����գ��÷�Ӧ�����ӷ���ʽΪ ��
(��֪��H2S Kal=9��1��10-8��Ka2=1��1 ��10-12��H2CO3 Kal=4��30��10-7��Ka2=5��61 ��10-11)
��1���ٽ�H2SO3��HSO3-������ΪSO42-; ��a ��2������ �����SO32- -2e-+H2O=SO42-+2H+;
��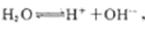 ������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��
������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ��
�� CO32-+H2S=HCO3-+HS-.
���������������2���������������ӵ��ƶ�����a�����ӵ�Դ������b�����ӵ�Դ����������b������������Ӧ�����������C��������������H+�ŵ�����H2��c��H+����С��ˮ�ĵ���ƽ�������ƶ���������ǿ������������Na2CO3��Һ����H2S����H2S Kal=9��1��10-8��Ka2=1��1 ��10-12��H2CO3 Kal=4��30��10-7��Ka2=5��61 ��10-11����֪����ǿ��˳��ΪH2CO3> H2S >HCO3->HS-,�Ӷ���Ӧ�����ӷ���ʽΪCO32-+H2S=HCO3-+HS-.
���㣺Ԫ�ػ�����֪ʶ�����ԭ����ԭ���ԭ����


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��Ϊ��֤��һˮ�ϰ�������ס��ҡ�����ͬѧ�ֱ��������ʵ�����̽����
�ټ�ͬѧ��pH��ֽ���������0��10 mol��L-1��ˮpHΪ10�����϶�һˮ�ϰ���������ʣ������� ��
����ͬѧȡ10 mL 0��10 mol��L-1��ˮ����pH��ֽ�����pHΪa��Ȼ��������ˮϡ����1000 mL������pH��ֽ�����pHΪb����Ҫȷ��һˮ�ϰ���������ʣ���a��bӦ����Ĺ�ϵ�� (�õ�ʽ��ʽ��ʾ)��
�۱�ͬѧȡ��10 mL 0��10mol��L-1��ˮ������2�η�̪��Һ���Էۺ�ɫ���ټ���NH4Cl�����������۲쵽�������� ����֤����ˮ�ϰ���������ʡ�
��2����25 mL 0��10 mol��L-l�������еμӰ�ˮ���������ù���������Ũ�ȴ�С��ϵ������ȷ���� ��
a��c(C1-)=c(NH4+)>c(H+)=c(OH-) b��c(C1-)>c(NH4+)=c(H+)>c(OH-)
c��c(NH4+)>c(OH-)>c(C1-)>c(H+) d��c(OH-)>c(NH4+)>c(H+)>c(C1-)
��3�������£�0��10mol��L-l��NH4Cl��ҺpHΪ5����һˮ�ϰ��ĵ��볣��Kb= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�Ͻ���ȡ�ظ����(K2Cr2O7)������(CrO3)��ʣ�������Ϊ��������ɷ�ΪSiO2��Al2O3��MgO��Fe2O3��CrO3��K2Cr2O7�ȡ�
��֪��
���ظ���غ�������������ˮ��������ɸ���Ⱦ����Ҫԭ�����Ƕ���ǿ������������������ˮ�����ԣ�
�ڣ�6�۸��ױ��������գ����°�����3�۸����ױ��������գ�����С��
���±�ΪһЩ�����������������pH�������ݡ�
| ���� | ��ʼ���� | ��ȫ���� |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
pC����pH,��ָ��ϡ��Һ��,�������ʵ���Ũ�ȵij��ö�����ֵ����ij��Һ���ʵ�Ũ��Ϊ1��10-3mol��L-1,�����Һ�����ʵ�pC=-lg(1��10-3)=3����ͼΪ,H2CO3�ڼ���ǿ���ǿ����Һ��,ƽ��ʱ��Һ�����ֳɷֵ�pC��pHͼ����ش���������: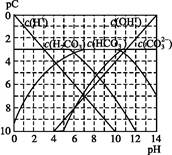
(1)������ѪҺ��,HC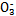 ����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����ʹ����ѪҺpH������7.35~7.45�����á������õ������Һ�е�ƽ�����:������������������������������(�����ӷ���ʽ��ʾ)��
����������ѪҺ��,HC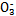 ��ˮ��̶�������������̶�(�<����>����=��)��
��ˮ��̶�������������̶�(�<����>����=��)��
��pH=7.00��ѪҺ��,c(H2CO3)��������c(HC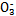 )(�<����>����=��)��
)(�<����>����=��)��
(2)H2CO3һ������ƽ�ⳣ������ֵ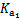 ������������
������������
(3)ijͬѧ��Ϊ����Һ��Na2CO3��ˮ��������,����ˮ���C ��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
��������������10%��������Ƽ�ʵ��֤����ͬѧ�Ĺ۵��Ƿ���ȷ
����
(4)��֪ij�¶���Li2CO3��KspΪ1.68��10-3,������Li2CO3��������100 mLˮ�����պñ���,����Li2CO3��Һ��c(Li+)="0.15" mol��L-1��c(C )="0.075" mol��L-1����t1ʱ����������ϵ�м���100 mL 0.125 mol��L-1 Na2CO3��Һ,��ʽ����˵���Ƿ��г���������
)="0.075" mol��L-1����t1ʱ����������ϵ�м���100 mL 0.125 mol��L-1 Na2CO3��Һ,��ʽ����˵���Ƿ��г���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������±ʯ(K2SO4��MgSO4��2CaSO4��2H2O)���ڡ�������ˮ�д�������ƽ�⣺
K2SO4��MgSO4��2CaSO4��2H2O(s) 2Ca2����2K����Mg2����4SO42����2H2O
2Ca2����2K����Mg2����4SO42����2H2O
Ϊ�ܳ�����ü���Դ���ñ���Ca(OH)2��Һ�ܽ���±ʯ�Ʊ�����أ������������£�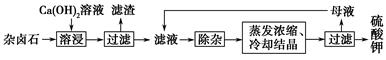
(1)������Ҫ�ɷ���________��________�Լ�δ����±ʯ��
(2)�û�ѧƽ���ƶ�ԭ������Ca(OH)2��Һ���ܽ���±ʯ����K����ԭ��_________________________________________________��
(3)�����ӡ������У��ȼ���________��Һ��������Ȳ������ˣ��ټ���________��Һ����ҺpH�����ԡ�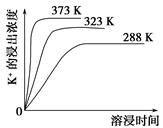
(4)��ͬ�¶��£�K���Ľ���Ũ�����ܽ�ʱ��Ĺ�ϵ��ͼ����ͼ�ɵã������¶����ߣ�
��________________________________________________________��
��________________________________________________________��
(5)�����Կ�����̼����Ϊ�ܽ��������ܽ������лᷢ����CaSO4(s)��CO32�� CaCO3(s)��SO42��
CaCO3(s)��SO42��
��֪298 Kʱ��Ksp(CaCO3)��2.80��10��9��
Ksp(CaSO4)��4.90��10��5������¶��¸÷�Ӧ��ƽ�ⳣ��K(������������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��.��֪:H2A��A2-�ɱ�ʾS2-��S ��S
��S ��Si
��Si ��C
��C �����ӡ�
�����ӡ�
(1)������,��20 mL 0.2 mol��L-1 H2A��Һ�еμ�0.2 mol��L-1 NaOH��Һ���й������ʵ����仯��ͼ(���Т����H2A,�����HA-,�����A2-)�������ͼʾ���: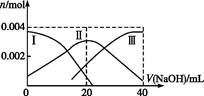
�ٵ�V(NaOH)="20" mLʱ,��Һ������Ũ�ȴ�С��ϵ:��������������������������
�ڵ������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�,����Һ��ˮ�ĵ���̶ȱȴ�ˮ��������(���С������ȡ�),��ʹNaHA��Һ������,���������м�������������
(2)��H2AΪ����:t��ʱ,��pH=2��ϡ�����pH=11��NaOH��Һ�������Ϻ���Һ������,����¶���ˮ�����ӻ�����KW=����������
��.��֪:��25 ��ʱ��H2O H++OH-��KW=10-14
H++OH-��KW=10-14
CH3COOH H++CH3COO-��Ka=1.8��10-5
H++CH3COO-��Ka=1.8��10-5
(3)������ˮ���ƽ�ⳣ��Kh�ı���ʽΪ��������,������ֵ=��������,�������¶�ʱ,Kh����������(�������С�����䡱)��
(4)0.5 mol��L-1��������ҺpHΪm,��ˮ��ij̶�(��ˮ��Ĵ�������ԭ�д����Ƶı�ֵ)Ϊa;1 mol��L-1��������ҺpHΪn,ˮ��ij̶�Ϊb,��m��n�Ĺ�ϵΪ��������,a��b�Ĺ�ϵΪ����������(����ڡ���С�ڡ����ڡ�)
��.(5)25 ��ʱ,��a mol��L-1�İ�ˮ��b mol��L-1�����������,��Ӧ����Һǡ��������,��a b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������
b(����ڡ���С�ڡ����ڡ�)����a��b��ʾNH3��H2O�ĵ���ƽ�ⳣ��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪0.1mol/L H2SO4��ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������0.1mol/L�����¼�����Һ�ĵ���ȣ����Ѿ�����ķ�����ռԭ�����������İٷ��������±����ش��������⣺
| ��H2SO4��Һ�е�HSO4�C | ��NaHSO4��Һ�е�HSO4�C | ��CH3COOH | ��HCl��Һ |
| 10�� | 29�� | 1.33�� | 100�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
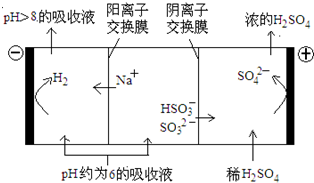
�������������Ű�ҹ��ֵ���������SO2����ɿ�������Ⱦ����Ҫԭ�������Ƽ�ѭ�����ɳ�ȥSO2��
��1���Ƽ�ѭ�����У�����ҺΪNa2SO3��Һ���÷�Ӧ�����ӷ���ʽ��________��
��2����֪H2SO3�ĵ��볣��ΪK1��1.54��10��2��K2��1.024��10��7��H2CO3�ĵ��볣��ΪK1��4.30��10��7��K2��5.60��10��11�������������Դ����������______������ţ���
A.CO32�� HSO3�� B. HCO3�� HSO3�� C. SO32�� HCO3�� D. H2SO3 HCO3��
��3������Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±���
| n(SO32��):n(HSO3��) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
A��B��C�� D�� E������Һ�ֱ���NaOH��NH3·H2O��CH3COOH ��HCl��NH4HSO4�е�һ�֡������½�������ʵ�飺
�ٽ�1 L pH=3��A��Һ�ֱ���0��001mol·L��1 xL B��Һ��0��001mol·L��1 yL D��Һ��ַ�Ӧ�����ԣ�x��y��С��ϵΪ�� y��x��
��Ũ�Ⱦ�Ϊ0��1mol·L��1A��E��Һ��pH��A��E��
��Ũ�Ⱦ�Ϊ0��1mol·L��1C��D��Һ�������ϣ���Һ�����ԡ�
�ش��������⣺
��1��D�� ��Һ���ж������� ��
��2����ˮϡ��0��1 mol·L��1Bʱ����Һ������ˮ�������Ӷ���С���� ����д��ţ�
��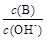 ��
�� 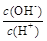 �� c��H+����c��OH-���ij˻� �� OH�������ʵ���
�� c��H+����c��OH-���ij˻� �� OH�������ʵ���
��3��OH��Ũ����ͬ�ĵ������������ҺA��E���ֱ���п�۷�Ӧ����������һ����Һ�д���п�ۣ��ҷų�������������ͬ��������˵����ȷ����________����д��ţ�
�ٷ�Ӧ����Ҫ��ʱ��E>A
�ڿ�ʼ��Ӧʱ������A>E
�۲μӷ�Ӧ��п�����ʵ���A=E
�ܷ�Ӧ���̵�ƽ������ E>A
��A��Һ����п��ʣ��
��E��Һ����п��ʣ��
��4����������������ʵ���Ũ��B��C��Ϻ���Һ�������¶ȣ����ʲ���ֽ⣩��ҺpH���¶ȱ仯��ͼ�е�_________���ߣ���д��ţ� �������£���0��01mol·L��1 C��Һ�еμ�0��01mol·L��1 D��Һ�����ԣ��õ�����Һ���������ӵ����ʵ� ��Ũ���ɴ�С��˳��Ϊ ��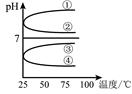
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com