
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是 。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是 (用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是 ,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb= 。
(1) ①如果氨水是强碱,0.10mol?L-1氨水pH为13,溶液的pH=10<13,所以一水合氨是弱碱;②(a-2)<b<a;③溶液的颜色变浅;
(2)abc;(3)1×10—5。
解析试题分析:(1)若证明一水合氨是弱碱,需从以下几个角度考虑:a、看电离程度b、看是否存在电离平衡c、测盐溶液的pH。 ①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是如果氨水是强碱,0.10mol?L-1氨水pH为13,溶液的pH=10<13,所以一水合氨是弱碱;②若是强碱,稀释100倍,pH减小2个单位,由于一水合氨是弱碱,稀释的过程中,促进电离,c(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;答案为:(a-2)<b<a;③如果一水合氨是弱碱,则存在电离平衡NH3·H2O  NH4+ + OH-,向氨水中加入氯化铵后,铵离子浓度增大,平衡逆向移动,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅;(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,a.氨水稍过量,混合液呈中性,c(C1-)=c(NH4+)>c(H+)=c(OH-) ,正确;b.盐酸过量,溶液为盐酸和氯化铵的混合液,溶液显酸性,c(C1-)>c(NH4+)=c(H+)>c(OH-),正确;c.氨水远远过量,溶液为氨水和氯化铵的混合液,一水合氨的电离程度大于铵离子的水解程度,溶液呈碱性,c(NH4+)>c(OH-)>c(C1-)>c(H+),正确;d.不可能出现c(OH-)>c(NH4+)>c(H+)>c(C1-),错误;选abc; (3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,NH4+的水解常数Kh=[H+][NH3·H2O]/[NH4+]=10—9,水合氨的电离常数
NH4+ + OH-,向氨水中加入氯化铵后,铵离子浓度增大,平衡逆向移动,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅;(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,a.氨水稍过量,混合液呈中性,c(C1-)=c(NH4+)>c(H+)=c(OH-) ,正确;b.盐酸过量,溶液为盐酸和氯化铵的混合液,溶液显酸性,c(C1-)>c(NH4+)=c(H+)>c(OH-),正确;c.氨水远远过量,溶液为氨水和氯化铵的混合液,一水合氨的电离程度大于铵离子的水解程度,溶液呈碱性,c(NH4+)>c(OH-)>c(C1-)>c(H+),正确;d.不可能出现c(OH-)>c(NH4+)>c(H+)>c(C1-),错误;选abc; (3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,NH4+的水解常数Kh=[H+][NH3·H2O]/[NH4+]=10—9,水合氨的电离常数
Kb=[OH-][NH4+]/[NH3·H2O]=Kw/Kh=1×10—5。
考点:考查强弱电解质的比较、酸碱混合溶液中离子浓度大小比较及电离平衡常数计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH(C6H5OH相当于一元弱酸):
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有 ;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是 ;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示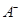 离子数目变化趋势的是 (填字母)。
离子数目变化趋势的是 (填字母)。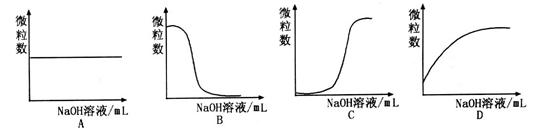
(2)现将1体积0.04mol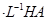 溶液和1体积0.02mol
溶液和1体积0.02mol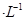 NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其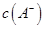 0.01 mol
0.01 mol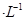 (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: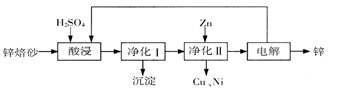
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃,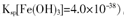 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25 ℃时部分弱电解质的电离平衡常数数据如表所示: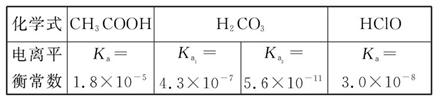
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列顺序是 (用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
| A.c(H+) |
| B.c(H+)/c(CH3COOH) |
| C.c(H+)·c(OH-) |
| D.c(OH-)/c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: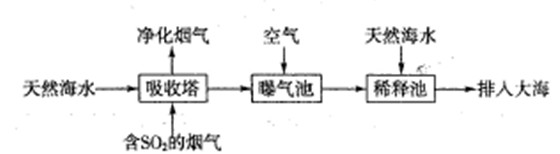
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)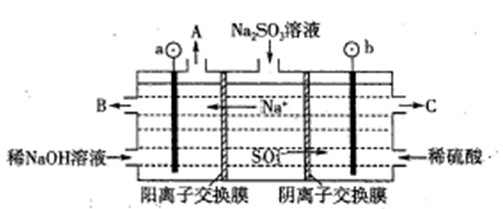
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
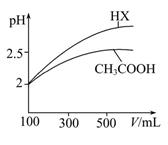
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是 ( )。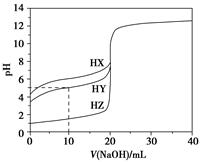
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com