
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
科目:高中化学 来源: 题型:填空题
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 |
| C.Na2CO3 | D.NH3·H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在a mL醋酸溶液中滴加0.01 mol·L-1的氢氧化钠溶液,滴定曲线如图所示。
(1)醋酸溶液浓度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b点,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)当醋酸与氢氧化钠溶液恰好完全中和时,曲线上对应的点Q应在____;
A.2与a之间 B.a与b之间
C.b与c之间 D.a与c之间
(4)下列关系式一定正确的是________。
A.a点,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c点,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c点,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是 。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是 (用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是 ,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下: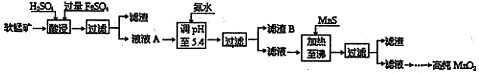
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 。
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2 +2H2C2O4 +3H2SO4=3MnSO4 +4CO2 ↑+6H2O,该方法的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在pH=5的稀醋酸溶液中,c(CH3COO-)= (列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸) V(醋酸),反应的最初速率为:v(盐酸) v(醋酸)(填“>”、“<”或“=”)。
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是 。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为 。
(5)已知:90 ℃时,水的离子积常数为KW=3.8×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)= (保留三位有效数字) mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com