
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(1)H2SO4=HSO4–+H+ HSO4– H++ SO42– (2分) (2)0.11 mol·L–1(2分)
H++ SO42– (2分) (2)0.11 mol·L–1(2分)
(3)③②④①或③>②>④>① (2分)
(4)c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+) (2分)
(5)1.77×10–5或1.8×10–5 (2分)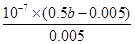 或(b-0.01)×10-5(2分)
或(b-0.01)×10-5(2分)
解析试题分析:(1)已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全,所以硫酸在水中的电离方程式为H2SO4=HSO4–+H+ HSO4– H++ SO42–。
H++ SO42–。
(2)H2SO4 = HSO4– + H+
0.1mol/L 0.1mol/L 0.1mol/L
HSO4–  H++ SO42–
H++ SO42–
0.1mol/L×10% 0.1mol/L×10%
所以溶液中氢离子浓度=0.1mol/L+0.1mol/L×10%=0.11mol/L
(3)硫酸是二元酸,第一步完全电离,第二步部分电离。盐酸是一元酸,完全电离。硫酸氢钠中HSO4-的电离程度强于醋酸的电离程度,所以常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是③>②>④>①。
(4)将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成硫酸钠,但由于SO42-水解SO42-+H2O HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
(5)醋酸的电离度是1.33%,则
CH3COOH CH3COO- + H+
CH3COO- + H+
起始浓度(mol/L) 0.1 0 0
转化浓度(mol/L) 0.1×1.33% 0.1×1.33% 0.1×1.33%
平衡浓度(mol/L)0.1-0.00133 0.00133 0.00133
所以该温度下醋酸的电离常数= =
=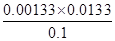 =1.77×10–5
=1.77×10–5
反应达平衡时,测得溶液的pH=7,则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH–)=c(Na+)+c(H+),因此c(OH–)=c(H+)=10-7mol/L、c(CH3COO-)+c(Cl-)=c(Na+)=0.5bmol/L,所以c(CH3COO-)=c(Na+)-c(Cl-)=0.5bmol/L-0.005mol/L。根据物料守恒可知溶液醋酸的浓度是0.5bmol/L-(0.5bmol/L-0.005mol/L)=0.005mol/L,所以该温度下醋酸的电离常数= =
=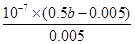 =(b-0.01)×10-5
=(b-0.01)×10-5
考点:考查弱电解质的电离、氢离子浓度与电离平衡常数计算以及溶液中离子浓度大小比较


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: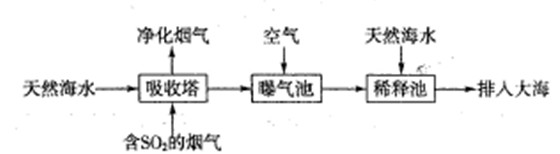
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)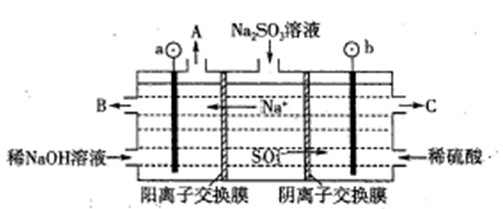
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将0.05 mol·L-1盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液12.5 mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA。
(1)此一元弱酸的物质的量浓度为 ;
(2)此条件下该一元弱酸的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
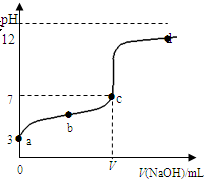
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下: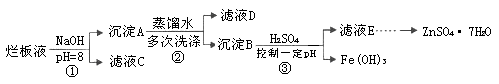
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com