
埋藏在地下的青铜器锈蚀过程可以表示为:Cu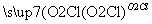
 CuCl
CuCl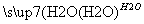 Cu2O―→X,X由两种物质X1和X2组成,且都由四种元素构成,定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生。为了定量测定X1和X2组成,某兴趣小组用如图实验装置对X1和X2分别做热分解实验(夹持装置已省去),实验结束后,硬质玻璃管内均残留黑色固体,分别称重,装置B和C中的质量均增加。
Cu2O―→X,X由两种物质X1和X2组成,且都由四种元素构成,定性实验表明:X1热分解的产物能使澄清石灰水变浑浊,而X2热分解的产物不能使澄清石灰水变浑浊,但两者均有水珠产生。为了定量测定X1和X2组成,某兴趣小组用如图实验装置对X1和X2分别做热分解实验(夹持装置已省去),实验结束后,硬质玻璃管内均残留黑色固体,分别称重,装置B和C中的质量均增加。

试回答下列问题:
(1)青铜器出土后防止青铜器继续锈蚀的关键是________________。
(2)利用上述装置进行热分解实验时,对判断A装置中反应是否完全进行带来困难,为解决此问题,要对B装置进行改装。B应改为内装有________(填试剂名称)的洗气瓶,判断反应完全的现象为__________________。
用经改装的装置,某同学进行正确操作,最终得出的测定结果仍有误差,原因是________________________________________________(回答一点即可)。
(3)在实验装置和实验操作正确的前提下,重做X1的热分解实验,测得装置B和C中质量增重之比Δm(B)∶Δm(C)=9∶22,________(填“能”或“否”)求出X1的化学式,若能求出X1的化学式,则化学式为______________(若不能求出X1的化学式,此空不填)。
(4)若测得X2中铜元素的质量分数为59.5%(铜元素的相对原子质量为63.5),则X2的化学式为______________________________________________。
X2热分解的化学方程式为_______________________________。
解析 先通过定性实验判断X1和X2的元素组成,加热分解均有水珠生成,说明都是碱式盐,X1受热分解产生CO2气体,说明X1中含有CO32-,因此X1的组成可表示为Cuz(OH )x(CO3)y,X2(由4种元素构成)受热分解无CO2气体生成,根据题中铜腐蚀过程变化示意图,可推测X2中含有的另一元素为Cl,X2的组成可表示为Cum(OH)nClp。
)x(CO3)y,X2(由4种元素构成)受热分解无CO2气体生成,根据题中铜腐蚀过程变化示意图,可推测X2中含有的另一元素为Cl,X2的组成可表示为Cum(OH)nClp。
(3)根据Δm(B)∶Δm(C)=9∶22=m(H2O)∶m(CO2),推出n(OH-)∶n(CO32-)=2∶1,根据化合价代数和等于0可得出X1的化学式为Cu2(OH)2CO3。
(4)X2的组成为Cum(OH)nClp,铜元素的质量分数的表达式为Cu%=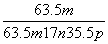 ×100%=59.5%,又根据化合价代数和等于0可得2m=n+p,解得n∶p=3∶1,故X2的化学式为Cu2(OH)3Cl。结合题中性质和现象不难写出热分解的化学方程式。[
×100%=59.5%,又根据化合价代数和等于0可得2m=n+p,解得n∶p=3∶1,故X2的化学式为Cu2(OH)3Cl。结合题中性质和现象不难写出热分解的化学方程式。[
答案 (1)与H2O和O2隔绝
(2)浓硫酸 洗气瓶中不再有气泡冒出 实验前装置内空气中的某些成分干扰了实验或反应结束后装置内的气体没有被B和C完全吸收
(3)能 Cu2(OH)2CO3
(4)Cu2(OH)3Cl Cu2(OH)3Cl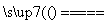 2C
2C uO+H2O↑+HCl↑
uO+H2O↑+HCl↑


科目:高中化学 来源: 题型:
某学生做实验后,采用下列方法清洗所有仪器:①用稀HNO3清洗做过银镜反应的试管②用酒精清洗做过碘升华的烧杯③用盐酸清洗长期盛放FeCl3溶液的试剂瓶④用盐酸溶液清洗盛过苯酚的试管。你认为他的操作
A.②不对 B.③不对 C.④不对 D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝土矿(主要成分为Al2O3,还含有SiO2及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
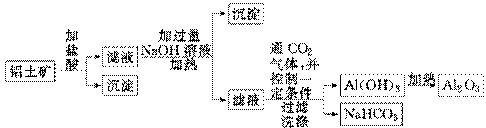
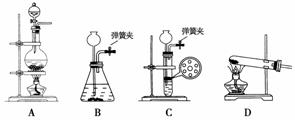
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置________(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有
________________________;洗涤沉淀的操作是
__________________ ______________________________________________________。
______________________________________________________。
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
此方案中所用药品的物质的量之比是:n(Al)∶n(H2SO4)∶n(NaOH)=________。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中、②先将铜与O2反应生成CuO,再溶于硝酸中、③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是 ( )。
A.方法③是最经济和环保的
B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好C.方法②需要消耗能源,对环境不产生污染
D.方法③中N2O4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物的应用范围很广。下列说法正确的是 ( )。
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应:Si+2NaOH+H2O===Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用胶体的知识解释的现象是
A. 向FeCl3溶液中加入NaOH溶液,出现红褐色沉淀
B. 一支钢笔使用两种不同牌号的墨水,易出现堵塞
C. 医疗上常用血液透析治疗由肾功能衰竭等疾病引起的尿毒症
D.江河入海处,易形成沙洲
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.298K,1.01×105Pa,64gSO2中含有的原子数为3NA
C. 11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LCCl4含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是  ( )。
( )。
A.两种微粒,若核外电子排布完 全相同,则其化学性质一定相同
全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元 素D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
素D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com