
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | ||||||||||||||||
试回答下列问题:
(1)请写出元素o的基态原子电子排布式________
(2)d的最简单氢化物的分子空间立体构型为_________,中心原子的杂化形式为_________;k在空气中燃烧产物的分子空间立体构型为________,中心原子的杂化形式为______,该分子是_____(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表______(填元素符号);其中电负性最大的是_______(填下图中的序号)。

(4)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比 熔点更高的是________(填化学式),试从结构角度加以解释:______________________________
【答案】 1s22s22p63s23p63d64s2或[Ar]3d64s2 三角锥形 sp3 V形 sp2 极性 Si 2 SiC 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中CSi键键长比晶体Si中SiSi键长短,键能大,因而熔沸点高
【解析】(1)元素o为Fe,原子序数为26,电子排布式为1s22s22p63s23p63d64s2,简写为[Ar]3d64s2,故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2。
(2)d为N,其氢化氢为NH3,N原子有1对孤对电子,成键数为3,N原子为sp3杂化,为三角锥形;k为S元素,在空气中燃烧生成SO2,S有1对孤对电子,存在S=O键,S原子采取sp2杂化,为V型,正负电荷中心不重合,为极性分子,故答案为:三角锥形;sp3;V型;sp2;极性。
(3)第三周期8种元素,只有Si单质为原子晶体,熔点最大,与图中8对应;分子晶体的熔点低,有磷、硫、氯气、氩气几种物质,但Cl的电负性最大,与图中2对应,故答案为:Si;2;
(4)j为Si,c为C,由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同,均为原子晶体,但SiC键键长<SiSi键长,则SiC键能大,SiC的熔点高,故答案为:SiC;因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中CSi键键长比晶体Si中SiSi键长短,键能大,因而熔沸点高;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO![]() →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
A. Fe3+ B. MnO![]() C. Cl2 D. HNO2
C. Cl2 D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下图,下列说法错误的是( )
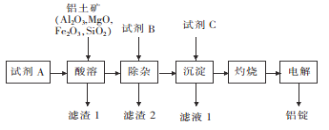
已知:滤渣2主要成分是Mg(OH)2、Fe(OH)3。
A. 试剂A可以是稀硫酸或盐酸B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2D. 试剂C应是NH3或氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅;②粗硅与Cl2加热反应制得四氯化硅;③四氯化硅经精馏提纯后与过量H2在高温下反应制得高纯硅。请依次写出所涉及的反应方程式:
①___________________________________________;
②____________________________________________;
③_____________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中发生的一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
(2)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为________________。从腐蚀废液中回收金属铜还需要的试剂是__________。
(3)与明矾相似,硫酸铁也可用于净水,其作用原理是____________________(用离子方程式表示);在使用时发现硫酸铁并不能使酸性废水中悬浮物沉降除去,其原因是_______________。
(4)铁红是一种红色颜料,其主要成分是Fe2O3。将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L氢气(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为________________________;
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.CO2与乙醇的浓度之比不再改变
b.单位时间内消耗H2和CO2的物质的量之比为3∶1
c.H2的体积分数保持不变
d.混合气体的平均相对分子质量不再改变

(3)在一定压强下,测得由CO2制取乙醇的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据分析:
①升高温度,平衡向________(正或逆)反应方向移动。
②在700 K、起始投料比![]() =1.5时,H2的体积分数为________(保留小数点后一位)。
=1.5时,H2的体积分数为________(保留小数点后一位)。
③在500 K、起始投料比![]() =2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
=2时,达到平衡后乙醇的浓度为a mol·L-1,则达到平衡时H2的浓度为________(保留小数点后两位)。
Ⅱ 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因为(可逆反应,用化学方程式表示)________________________________,且汽缸内温度越高,单位时间内NO排放量越大,试分析其原因____________________。

(2)治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应原理:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g) ΔH<0。某研究小组在三个容积均为5L的恒容密闭容器中,分别充入0.2molNO和0.2molCO,在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示。
①计算实验Ⅱ从开始至达到平衡时的反应速率v(NO)=________________。
②图中三组实验从开始至达到平衡时的反应速率v(NO)由小到大的顺序为________(填序号)。
③与实验Ⅱ相比,实验Ⅰ和实验Ⅲ分别仅改变一种反应条件,所改变的条件为:实验Ⅰ_______________________________;实验Ⅲ_______________________。
④三组实验中CO的平衡转化率αⅠ(CO)、αⅡ(CO)、αⅢ(CO)的大小关系为______________。判断依据为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com