
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转。结构简式为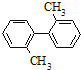 的烃的下列说法正确的是( )
的烃的下列说法正确的是( )
A. 分子中最多有16个原子处于同一平面上
B. 该烃的一氯代物最多有4种
C. 该烃是苯的同系物
D. 分子中至少有9个碳原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:

已知:① (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)J的名称为____________。E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为______________________________________________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:_________________________________________________。
)的合成路线:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 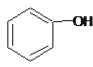 和
和 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式一定为C2H5-OH
D. 分子式为C4H8的有机物可能存在4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24 LCCl4中含Cl原子数目为0.4NA
B. 28g聚乙烯中所含原子数为6NA
C. 0.1mol苯乙烯中含有双键的数目为0.4NA
D. 15g甲基(—CH3)中含有电子的数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品中Na2CO3的纯度(质量分数)是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 有能量变化的过程均为化学变化
B. 氢氧化钡晶体与氯化铵晶体的反应为放热反应
C. 反应物的总能量高于生成物的总能量时发生放热反应
D. 旧化学键断裂所放出的能量低于新化学键形成所吸收的能量时发生吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN+H2O2→N2↑+X+H2O推测X的化学式为________。
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e∶f的值为________(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(3)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:___________________________;
②若结果测得CO2的质量为1.408 g,则该实验中测得CN-被处理的百分率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | ||||||||||||||||
试回答下列问题:
(1)请写出元素o的基态原子电子排布式________
(2)d的最简单氢化物的分子空间立体构型为_________,中心原子的杂化形式为_________;k在空气中燃烧产物的分子空间立体构型为________,中心原子的杂化形式为______,该分子是_____(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表______(填元素符号);其中电负性最大的是_______(填下图中的序号)。

(4)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比 熔点更高的是________(填化学式),试从结构角度加以解释:______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com