
【题目】“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN+H2O2→N2↑+X+H2O推测X的化学式为________。
② NaClO处理法:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O方程式中e∶f的值为________(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
(3)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:___________________________;
②若结果测得CO2的质量为1.408 g,则该实验中测得CN-被处理的百分率为_____________。
【答案】DNaHCO3B2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O80%
【解析】
(1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙覆盖来灭火,故答案为:D;
(2)①NaCN+H2O2→N2↑+X+H2O中,由原子守恒可知X为NaHCO3,故答案为:NaHCO3;
②由CN-离子中碳与氮原子之比为1:1,而碳氮转化为CNO-和N2以及CO32-,又因为CNO-离子碳氮之比为1:1,所以N2和CO32-两微粒之比为1:2,所以e:f=1:2,故答案为:B;
(3)①根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl2,反应离子方程式为2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O,故答案为:2CNO-+6ClO-+8H+═N2↑+2CO2↑+3Cl2↑+4H2O;
②干燥管Ⅰ中碱石灰增重1.408g为二氧化碳的质量,物质的量为![]() =0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为
=0.032mol,根据碳元素守恒可知被处理的CN-的物质的量为n(CN-)=n(CO2)=0.032mol,原溶液中CN-的物质的量为0.2L×0.2mol/L=0.04mol,所以该实验中测得CN-被处理的百分率为![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于铵盐的描述都正确的是( )
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使湿润的红色石蕊试纸变蓝
A.全部
B.①②⑤⑥
C.①②⑤
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是从海水中提取食盐和溴的主要流程。

(1)粗盐除含 NaCl 外,还含有少量 MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是粗盐提纯的
操作流程。

提供的试剂:
Na2CO3溶液、 K2CO3溶液、 NaOH 溶液、 BaCl2溶液、 Ba(NO3)2溶液、饱和 NaCl 溶液。
①除去溶液 I 中的 MgCl2、 CaCl2、 Na2SO4,从提供的试剂中选出 a 所代表的试剂,按滴加顺序依次为: 过量的NaOH 溶液、_______、_______;
②如何证明操作①中 NaOH 溶液已经过量?_______。
③蒸发过程所用的主要仪器有:铁架台、酒精灯、_______;
(2)某同学在实验室中用四氯化碳萃取较高浓度的溴水中的溴,经振荡并在铁架台上静置分层后,
①分离出四氯化碳层的操作是:_______。
②分离溴的四氯化碳溶液的操作方法是:_______。
(3)工业上将较高浓度的溴水经进一步处理得到工业溴。某研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料, Br2的沸点为 59℃,微溶于水,有毒性和强腐蚀性。水的沸点为 100℃。他们参观生产过程后,设计了如下装置简图:

①图中仪器 B 的名称:_______。
②用热水浴加热的优点是:_______。
③实验装置气密性良好,要达到提纯溴的目的,收集溴时温度计应控制的温度为:_______℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列空白。
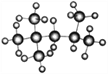
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,下图是异辛烷的球棍模型,则异辛烷的系统命名为_________________。
(2)写出下列反应的化学方程式和反应类型
①2—溴丙烷与NaOH溶液:________________________。
②苯酚和饱和溴水:____________________________。
(3)有机物A可以通过不同的反应得到B和C:
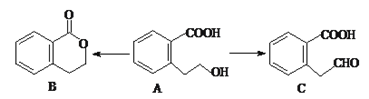
①A的分子式为___________________,C的含氧官能团名称为___________________。
②A制取B的有机反应类型为________________。
③A制取C的化学方程式为:_____________________________________________。
④A发生消去反应后产物的结构简式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O中,下列说法正确的是( )
A. 氧化产物与还原产物物质的量之比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的![]()
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全发生还原反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO![]() →Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
→Mn2+;Cl2→2Cl-;HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,则得到I2最多的是( )
A. Fe3+ B. MnO![]() C. Cl2 D. HNO2
C. Cl2 D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下图,下列说法错误的是( )
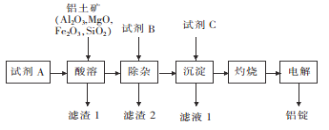
已知:滤渣2主要成分是Mg(OH)2、Fe(OH)3。
A. 试剂A可以是稀硫酸或盐酸B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2D. 试剂C应是NH3或氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com