
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:

已知:① (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)J的名称为____________。E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为______________________________________________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:_________________________________________________。
)的合成路线:_________________________________________________。
【答案】 环己醇 碳碳双键、羟基 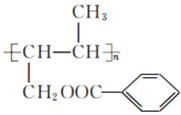 加成反应、消去反应
加成反应、消去反应 ![]() +H2O
+H2O![]()
![]() +CH3CH2OH CH3CH=CHCHO+2Ag(NH3)2OH
+CH3CH2OH CH3CH=CHCHO+2Ag(NH3)2OH![]() CH3CH=CHCOONH4+3NH3+2Ag↓+H2O 6 CH3CH2Cl
CH3CH=CHCOONH4+3NH3+2Ag↓+H2O 6 CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
【解析】根据已知:① ,
,![]() 在过氧化物作用下生成A为
在过氧化物作用下生成A为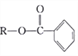 ;
; 在酸性条件下水解生成苯甲酸和ROH,根据后面反应情况可知B为ROH,F为苯甲酸,ROH在铜的催化下与氧气反应生成RCHO,RCHO在氢氧化钠水溶液中发生类似已知②2R-CH2CHO
在酸性条件下水解生成苯甲酸和ROH,根据后面反应情况可知B为ROH,F为苯甲酸,ROH在铜的催化下与氧气反应生成RCHO,RCHO在氢氧化钠水溶液中发生类似已知②2R-CH2CHO![]()
![]() ,结合D的相对分子质量为70可推出D为CH3CH=CHCHO,则C为乙醛,B为乙醇;-R为甲基;D与氢气发生加成反应生成相对分子质量为72的E,E为CH3CH=CHCH2OH;CH3CH=CHCH2OH与苯甲酸发生酯化反应生成G为
,结合D的相对分子质量为70可推出D为CH3CH=CHCHO,则C为乙醛,B为乙醇;-R为甲基;D与氢气发生加成反应生成相对分子质量为72的E,E为CH3CH=CHCH2OH;CH3CH=CHCH2OH与苯甲酸发生酯化反应生成G为![]() ,
,![]() 发生加聚反应生成高分子H为
发生加聚反应生成高分子H为 ;苯与氢气在催化剂作用下发生加成反应生成环已烷,环已烷在光照条件下与氯气发生取代反应后再氢氧化钠水溶液中发生水解反应生成J为环己醇,环己醇在铜的催化下与氧气发生氧化反应生成K为环已酮,环已酮在氢氧化钠作用下反应生成L为
;苯与氢气在催化剂作用下发生加成反应生成环已烷,环已烷在光照条件下与氯气发生取代反应后再氢氧化钠水溶液中发生水解反应生成J为环己醇,环己醇在铜的催化下与氧气发生氧化反应生成K为环已酮,环已酮在氢氧化钠作用下反应生成L为![]() ,
,![]() 发生水解反应生成M为HOOC(CH2)4CH2OH。(1)J的名称为环己醇;E为CH3CH=CHCH2OH,所含官能团的名称为碳碳双键、羟基;H的结构简式为
发生水解反应生成M为HOOC(CH2)4CH2OH。(1)J的名称为环己醇;E为CH3CH=CHCH2OH,所含官能团的名称为碳碳双键、羟基;H的结构简式为 ;(2)C→D是乙醛在氢氧化钠水溶液中发生分子间的加成反应生成CH3CH(OH)CH2CHO,再发生消去反应生成CH3CH=CHCHO和水,涉及的反应类型有加成反应、消去反应;(3)A→B+F的化学方程式为
;(2)C→D是乙醛在氢氧化钠水溶液中发生分子间的加成反应生成CH3CH(OH)CH2CHO,再发生消去反应生成CH3CH=CHCHO和水,涉及的反应类型有加成反应、消去反应;(3)A→B+F的化学方程式为![]() +H2O
+H2O![]()
![]() +CH3CH2OH;(4)D为CH3CH=CHCHO,与银氨溶液反应的化学方程式为CH3CH=CHCHO+2Ag(NH3)2OH
+CH3CH2OH;(4)D为CH3CH=CHCHO,与银氨溶液反应的化学方程式为CH3CH=CHCHO+2Ag(NH3)2OH![]() CH3CH=CHCOONH4+3NH3+2Ag↓+H2O;(5) M为HOOC(CH2)4CH2OH,符合条件:①官能团种类和数目与M相同,则含有一个羟基和一个羧基,②分子中含有1个-CH3和1个-CH2CH2-
CH3CH=CHCOONH4+3NH3+2Ag↓+H2O;(5) M为HOOC(CH2)4CH2OH,符合条件:①官能团种类和数目与M相同,则含有一个羟基和一个羧基,②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-,故除了末端的甲基、羟基和羧基外,结构为 ,若甲基在1位,另外两取代基分别在2、3和3、2两种;若羟基在1位,另外两取代基分别在2、3和3、2两种;若羧基在1位,另外两取代基分别在2、3和3、2两种;故同分异构体有6种; (6) 一氯乙烷在氢氧化钠的水溶液中加热发生取代反应生成乙醇,乙醇氧化得到乙醛,乙醛和苯甲醛在氢氧化钠溶液中反应生成
,若甲基在1位,另外两取代基分别在2、3和3、2两种;若羟基在1位,另外两取代基分别在2、3和3、2两种;若羧基在1位,另外两取代基分别在2、3和3、2两种;故同分异构体有6种; (6) 一氯乙烷在氢氧化钠的水溶液中加热发生取代反应生成乙醇,乙醇氧化得到乙醛,乙醛和苯甲醛在氢氧化钠溶液中反应生成![]() ,
,![]() 与氢气发生加成反应生成苄基乙醛(
与氢气发生加成反应生成苄基乙醛(![]() ),合成路线为:CH3CH2Cl
),合成路线为:CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
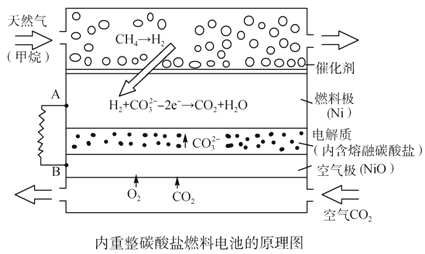
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 2HI![]() H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2 ![]() HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为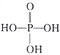 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
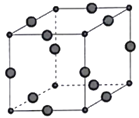
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的下列说法中正确的是( )
A. 在外电路中电子由正极流向负极
B. 在原电池中负极发生还原反应
C. 阳离子向正极方向移动
D. 原电池中正极一定是不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com