
【题目】下列事实,不能用勒夏特列原理解释的是
A. 2HI![]() H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2 ![]() HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料(
)和PC塑料( )的合成路线如下:
)的合成路线如下:

(1)A的名称是 ___________。
(2)C的结构简式____________。
(3)下列说法正确的是(选填字母)_______________。
A. 反应Ⅱ的原子利用率为100%
B. 反应Ⅲ为取代反应
C. 1 mol E与足量金属 Na 反应,最多可生成标准状况下22.4 L H2
D. CH3OH在合成PC塑料的过程中可以循环利用
(4)反应Ⅰ的化学方程式是_______________________________。
(5)反应Ⅳ的化学方程式是_______________________________。
(6)已知:

以D和乙酸为起始原料合成![]() 无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:

已知:i.Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSOa4]2+;
ii.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
iii.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol/L。请回答下列问题:
(1)铈的原子序数是58,它在元素周期表的位置是_________________________。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是____________________、_________________(写出2种即可)。
(3)“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为________________。浸出的过程中常加入适量的Na2SO4浓溶液,其作用是_____________________________。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
(5)“反萃取”中加H2O2的主要反应离子方程式为_______________________。在“反萃取”后所得水层中加入1.0mol/L的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol/L],溶液中c(CO32-)约为______________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(ZnS)=2.0×1022,Ksp(CuS)=1.3×1036,向等物质的量浓度ZnSO4和CuSO4的混合溶液中,逐滴加入1.5 mol·L1的Na2S溶液直至溶液中无沉淀产生,然后过滤。下列说法不正确的是
A. 先生成CuS后生成ZnS沉淀,属于沉淀的转化
B. 当ZnS沉淀完全时,溶液中![]() =6.5×1015
=6.5×1015
C. 过滤得到的沉淀是CuS和ZnS的混合物
D. 过滤后得到的溶液中仍有极少量的Cu2+和Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:

已知:① (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)J的名称为____________。E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为______________________________________________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:_________________________________________________。
)的合成路线:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
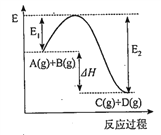
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com