
【题目】溶液和胶体本质区别是( )
A.微粒直径的大小B.观察外观C.电泳D.丁达尔效应
科目:高中化学 来源: 题型:
【题目】钠-氯化镍电池以 β-Al2O3(Al2O3x Na2O)作为固体电解质构成的一种新型电池(2Na+NiCl2![]() Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
A. 放电时 NaCl在熔融电解质中生成
B. 充电时阴极反应: Na+ + e- ═ Na
C. 氯离子通过β-Al2O3(s)在两电极间移动
D. 如果电池过度放电, AlCl4-可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
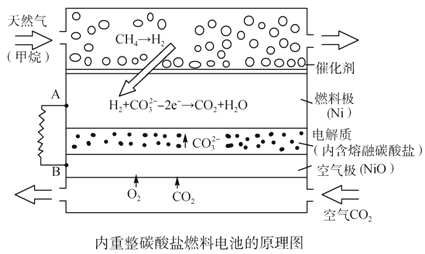
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
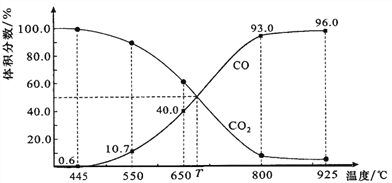
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E 是合成一种眼科表面麻醉用药的中间体,其合成路线如下:

(1)E 中的含氧官能团名称为硝基、_________、____________(写两种)。
(2)D→E 的反应类型为________________________。
(3)反应A→B 的化学方程式为_________________________。从整个流程看,设计A→B 这一步的目的是________________________________________。
(4)D 有多种同分异构体,同时满足下列条件的D 的同分异构体(不含立体异构)有____种,其中属于a氨基酸的同分异构体的结构简式为_________________________。(不写立体异构)。
①分子中同时含有苯环、醛基、羧基和氨基,且分子中有一个手性碳原子;②分子中有6 种不同化学环境的氢;③不能与FeCl3溶液发生显色反应。
(5)请以![]() 和C2H5OH 为有机原料制备医药中间体(
和C2H5OH 为有机原料制备医药中间体(![]() ),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 ![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 2HI![]() H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2 ![]() HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为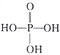 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
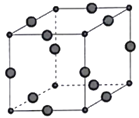
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com