
【题目】钠-氯化镍电池以 β-Al2O3(Al2O3x Na2O)作为固体电解质构成的一种新型电池(2Na+NiCl2![]() Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
A. 放电时 NaCl在熔融电解质中生成
B. 充电时阴极反应: Na+ + e- ═ Na
C. 氯离子通过β-Al2O3(s)在两电极间移动
D. 如果电池过度放电, AlCl4-可能被还原
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
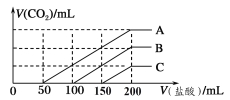
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上有广泛应用。已知氮化锶遇水剧烈反应产生氢氧化锶和氨气。
锶和镁位于同主族且锶比镁活泼, 锶与氮气在加热条件下反应产生氮化锶。某学习小组拟设计两套方案制备氮化锶:
方案Ⅰ:根据下列装置制备氮化锶。
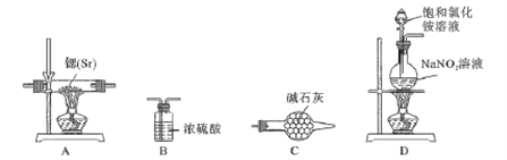
已知:实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气。
回答下列问题:
(1)气流从左至右,选择装置并排序为___________(填字母表示)。
(2)写出实验室制备N2的化学方程式____________
(3)实验时先点燃_____处酒精灯(填“A”或“D”),一段时间后,点燃另一只酒精灯。
(4)氮化锶遇水发生反应的化学方程式为____________
方案Ⅱ:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸牧CO能力;连苯三酚鹹性溶液能定量吸收O2.
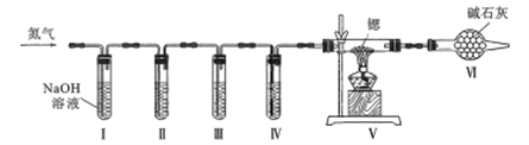
(5)试管Ⅱ盛装的试剂是__________填代号)。
a.连苯三酚碱性溶液b.醋酸二氨合亚铜溶液 C.浓巯酸d.赤热铜粉
装置Ⅵ的作用是_______________
(6)测定产品纯度:取wg产品,向其中加入适量的水。将产生的气体全部通人到依硫酸中,依硫酸增重mg,则产品纯度为__(用代数式表示)。有同学认为上述方法使测得产品纯度偏高,其原因是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
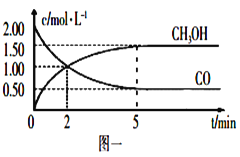
①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ/mol;
CaCO3(s)+2H2(g)的△H=_______kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
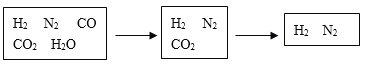
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
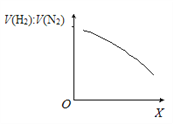
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、![]() 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是![]() 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(![]() )和PC塑料(
)和PC塑料( )的合成路线如下:
)的合成路线如下:

(1)A的名称是 ___________。
(2)C的结构简式____________。
(3)下列说法正确的是(选填字母)_______________。
A. 反应Ⅱ的原子利用率为100%
B. 反应Ⅲ为取代反应
C. 1 mol E与足量金属 Na 反应,最多可生成标准状况下22.4 L H2
D. CH3OH在合成PC塑料的过程中可以循环利用
(4)反应Ⅰ的化学方程式是_______________________________。
(5)反应Ⅳ的化学方程式是_______________________________。
(6)已知:

以D和乙酸为起始原料合成![]() 无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
无机试剂任选,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)+nB(g)pC(g)+qD(g)+Q (Q>0),且m+n>p+q,使平衡向正反应方向移动的条件是( )
A.降温、降压B.升温、降压C.降温、增压D.升温、增压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com