
【题目】对于可逆反应mA(g)+nB(g)pC(g)+qD(g)+Q (Q>0),且m+n>p+q,使平衡向正反应方向移动的条件是( )
A.降温、降压B.升温、降压C.降温、增压D.升温、增压
科目:高中化学 来源: 题型:
【题目】有一瓶无色澄清的溶液,溶质由NH4NO3、KCl、CuCl2、K2CO3、Na2CO3中的一种或几种配制而成。为了确定其中的溶质,用该溶液做如下实验:
(1)取少许溶液,加入足量的盐酸有气泡产生
(2)再向(1)的溶液中滴加硝酸银溶液有白色沉淀生成
(3)取原溶液少量,加入NaOH溶液并加热,产生刺激性气味的气体,并用湿润的红色石蕊试纸检验气体,试纸变蓝
(4)用铂丝蘸取原溶液于煤气灯上灼烧,火焰呈黄色
根据以上事实判断:肯定存在的溶质是___________________________;肯定不存在的溶质是_______; 不能确定是否存在的溶质是________________。写出上述实验(3)中产生刺激性气味气体的反应的化学方程式:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠-氯化镍电池以 β-Al2O3(Al2O3x Na2O)作为固体电解质构成的一种新型电池(2Na+NiCl2![]() Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
A. 放电时 NaCl在熔融电解质中生成
B. 充电时阴极反应: Na+ + e- ═ Na
C. 氯离子通过β-Al2O3(s)在两电极间移动
D. 如果电池过度放电, AlCl4-可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
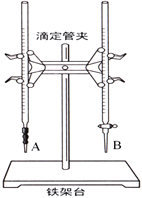
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
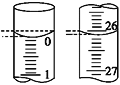
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. X的最高价氧化物的水化物能溶解在Z的最高价氧化物的水化物溶液中
B. W、X、Z的简单离子均能促进水的电离
C. W的氢化物与X、Y、Z的氧化物均不反应
D. 原子半径:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
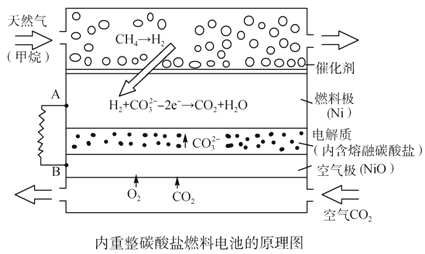
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
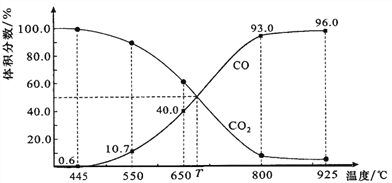
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为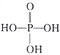 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
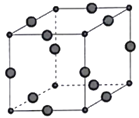
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com