
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
【答案】 2FeCl2+Cl2===2FeCl3 浅绿色 不变色 Fe2++Zn===Zn2++Fe Fe2+ ![]() +5Fe2++8H+===Mn2++5Fe3++4H2O Fe5O7
+5Fe2++8H+===Mn2++5Fe3++4H2O Fe5O7
【解析】
(1)①根据分析可以知道:加入氧化剂氯水会氧化亚铁离子为铁离子,化学反应方程式为:2FeCl2+Cl2=2FeCl3;因此,本题正确答案是:2FeCl2+Cl2=2FeCl3;②探究铁离子具有氧化性,根据图表中实验步骤,取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液,加入铁粉后,发生反应Fe+2FeCl3=3FeCl2,溶液颜色变为浅绿色,加入硫氰酸钾溶液不变红色,证明无铁离子;③锌和亚铁离子反应发生置换反应生成铁和锌离子,反应的离子方程式为:Fe2++Zn═Zn2++Fe;
(2)已知MnO4-在反应中得到电子,根据氧化还原反应电子守恒,元素化合价有升高和降低,所以判断X为亚铁离子失电子发生氧化反应;高锰酸根离子具有氧化性在酸溶液这氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(3)![]() ,
,![]() ,所以
,所以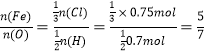 ,即该氧化物的化学式为Fe5O7。
,即该氧化物的化学式为Fe5O7。


科目:高中化学 来源: 题型:
【题目】研究铝元素、硫元素及其化合物的性质具有重要意义
(1)①NH4A1(SO4)2可作净水剂,用必要的化学用语及文字说明其理由是_________。
②相同条件下,0.1mol NH4A1(SO4)2溶液中的c(NH4+)______(填“大于”“小于”或“等于”)0.1mol·L-1NH4HSO4溶液中的c(NH4+)。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_____mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=______。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,配成500mL溶液
B.称取12.0g胆矾,加入500mL水
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )

A、12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B、该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C、2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D、该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) △H2=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) △H2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则△H2=_______kJ/mol(用E1、E2表示)。

(3)H2(g)的燃烧热为_______。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。

(1)基态Fe原子价层电子排布式是_______。
(2)已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为_______晶体。
(3)二茂铁甲酰胺中碳原子的杂化方式为_________,H、C、N、O四种元素的电负性由大到小的顺序是_________。
(4)碳、氮元素对应的最简单氢化物分别是CH4和NH3,相同条件下CH4的沸点比NH3的沸点_______(填“高”或“低”),主要原因是_______。
(5)氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是_______,1 mol阴离子含有σ键的数目为_______。
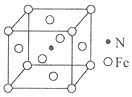
(6)氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为_______。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=_______g/cm3(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中键角由大到小排列顺序是
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③ B.⑤①④②③
C.④①②⑤③ D.③②④①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g) ![]() N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )

A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com