
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
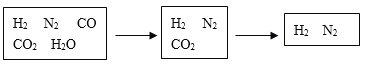
(1)步骤ⅰ,发生的是CO变换反应。
①CO变换反应的化学方程式是____________________________________。
②一定条件下,向体积固定为1 L的密闭容器中充入一定量半水煤气,发生CO变换反应。下图表示氢气与氮气的平衡体积比[V(H2):V(N2)]随外部条件X的变化关系。
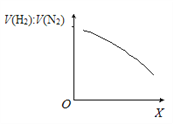
Ⅰ.X代表的物理量是______________________________。
Ⅱ.CO变换反应的△H _____0(填“>”或“<”),判断的依据是_____________________________。
③若用a、b、c、d 分别代表CO变换反应中相关化学键:H-H、H-O、![]() 、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是
、C=O的键能(kJ·mol-1)的数值,已知CO的结构式是![]() 。消耗1mol CO时,该反应的热效应 △H = _______________。
。消耗1mol CO时,该反应的热效应 △H = _______________。
(2)步骤ⅱ中,用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2。
①当溶液pH降至10的过程中(无沉淀析出),溶液中离子浓度关系正确的是________(选填字母)。
a.c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L
b.c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
c.c(Na+)>c(CO32-)>c(HCO3-)
②当脱除液失效时,请设计一种可使其再生的方法(结合化学方程式说明):___________________________。
【答案】 CO +H2O(g) =CO2+H2 温度 < 温度升高时,平衡向吸热方向移动,氢气与氮气的体积比减小 c+2b-2d-a b 2NaHCO3 ![]() Na2CO3 + CO2↑ +H2O
Na2CO3 + CO2↑ +H2O
【解析】试题分析:(1)①CO变换反应是CO与H2O(g)反应生成CO2和H2;②根据图像,随X的增大,V(H2):V(N2)减小,说明氢气减少,CO +H2O(g) =CO2+H2反应逆向进行,根据影响平衡移动的因素分析;③△H=反应物的总键能-生成物的总键能;(2)①用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2,Na2CO3转化为NaHCO3。②当脱除液完全生成碳酸氢钠时失效,加热可使碳酸氢钠分解为碳酸钠;
解析:(1)①CO变换反应是CO与H2O(g)反应生成CO2和H2,反应方程式是CO +H2O(g) =CO2+H2;②Ⅰ. 根据影响平衡移动的因素,增大压强,该反应平衡不移动,改变温度平衡移动;Ⅱ.随温度升高,V(H2):V(N2)减小,说明氢气的减少,CO +H2O(g) =CO2+H2反应逆向进行,所以CO变换反应的△H<0;③△H=反应物的总键能-生成物的总键能,消耗1mol CO时,该反应的热效应 △H =c+2b-2d-a;(2)①用2.0 mol/L Na2CO3溶液作吸收剂脱除CO2,Na2CO3转化为NaHCO3;根据物料守恒,原溶液中c(CO32-)+c(HCO3-) + c(H2CO3) =2.0 mol/L,吸收一定量CO2后,c(CO32-)+c(HCO3-) + c(H2CO3) >2.0 mol/L,故a错误;根据电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故b正确;溶液中有碳酸氢钠生成,所以c(HCO3-)可能大于c(CO32-),故c错误。②当脱除液完全生成碳酸氢钠时失效,加热可使碳酸氢钠分解为碳酸钠,反应方程式是2NaHCO3 ![]() Na2CO3 + CO2↑ +H2O;
Na2CO3 + CO2↑ +H2O;


科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:①该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
②牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水成分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是____________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有_______。
(3)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_____________________________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________。
(6)将等体积的AlCl3与NaOH溶液混合,充分反应后,测得混合溶液中含有铝元素质量是沉淀中含有铝元素质量的2倍,则c(AlCl3)与c(NaOH)的比值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠-氯化镍电池以 β-Al2O3(Al2O3x Na2O)作为固体电解质构成的一种新型电池(2Na+NiCl2![]() Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
Ni+2NaCl ), 其结构如图所示。下列关于该电池的叙述错误的是
A. 放电时 NaCl在熔融电解质中生成
B. 充电时阴极反应: Na+ + e- ═ Na
C. 氯离子通过β-Al2O3(s)在两电极间移动
D. 如果电池过度放电, AlCl4-可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 用金属钠可区分乙醇和乙醚
B. 用高锰酸钾酸性溶液可区分己烷和3-己烯
C. 用水可区分苯和溴苯
D. 用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
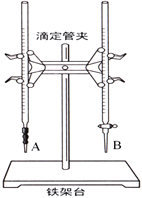
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
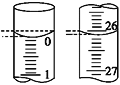
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. X的最高价氧化物的水化物能溶解在Z的最高价氧化物的水化物溶液中
B. W、X、Z的简单离子均能促进水的电离
C. W的氢化物与X、Y、Z的氧化物均不反应
D. 原子半径:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 ![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2mole-通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com