
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
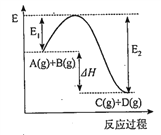
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 2HI![]() H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2 ![]() HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(![]() )碳原子的杂化方式为_________。
)碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29的Cu的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于________。
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. AlN中氮的化合价为+3
C. 上述反应中,每生成1 molAlN需转移3 mol电子
D. AlN的摩尔质量为41 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com