
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29的Cu的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于________。
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是________。
【答案】  CuS、FeS Na2BeO2+4HCl=BeCl2+2NaCl+2H2O dbfc 蒸发结晶时向溶液中持续通入HCl气体(或在HCl气流中加热蒸干) MnO2+CuS+4H+=S+Mn2++Cu2++2H2O 产生污染环境的气体 Fe3+ 4
CuS、FeS Na2BeO2+4HCl=BeCl2+2NaCl+2H2O dbfc 蒸发结晶时向溶液中持续通入HCl气体(或在HCl气流中加热蒸干) MnO2+CuS+4H+=S+Mn2++Cu2++2H2O 产生污染环境的气体 Fe3+ 4
【解析】(1)根据电子排布规律可得Cu的原子结构示意图为 。
。
(2)根据旧铍铜原件的成分BeO、CuS、FeS和SiO2的性质,结合已知Ⅰ铍、铝两元素的化学性质相似,BeO属于两性氧化物,SiO2属于酸性氧化物,二者都能溶于NaOH溶液中,生成Na2BeO2和Na2SiO3,而不溶物为CuS和FeS,所以滤渣B的主要成分为CuS和FeS;滤液A中主要成分是NaOH、Na2SiO3、Na2BeO2,所以反应Ⅰ中含铍化合物即Na2BeO2,与过量盐酸反应的化学方程式为Na2BeO2+4HCl =BeCl2+2NaCl+ 2H2O。
(3)①溶液C中含NaCl、BeCl2和少量HCl,根据Be与Al的性质相似,可得BeCl2可与氨水反应生成Be(OH)2沉淀,经过虑,洗涤后再与适量的盐酸反应即可提纯BeCl2,所以提纯BeCl2合理的步骤是dbfc;②为防止Be2+水解,要在HCl气流中加热蒸干。
(4) ①根据叙述即可写出反应Ⅱ中CuS发生反应的离子方程式为MnO2+CuS+4H+=S+Mn2++ Cu2++ 2H2O;②用浓HNO3溶解金属硫化物时,浓硝酸被还原为氮的氧化物,污染环境(浓硝酸腐蚀性强,氧化性强,可能把S氧化为SO2,污染环境)。
(5)根据Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.l×10-13,可知Cu2+转化成沉淀时,c(OH-)= ![]() mol/L,同理计算出Fe3+转化成沉淀时,c(OH-)=
mol/L,同理计算出Fe3+转化成沉淀时,c(OH-)=![]() mol/L,Mn2+转化成沉淀时,c(OH-)=
mol/L,Mn2+转化成沉淀时,c(OH-)=![]() mol/L,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10 mol/L,则pH=4,当pH>4时,Cu2+出现沉淀。
mol/L,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10 mol/L,则pH=4,当pH>4时,Cu2+出现沉淀。
(6) 已知旧铍铜原件中含BeO25%,所以BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250g/25g/mol=10mol,即90g,但实际得到Be的质量为72g,所以Be的产率是72g/90g×100% =80%。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是铝箔在氧气中燃烧的实验,请回答下列问题:
(1)铝在氧气中燃烧的化学方程式为______________________。
(2)实验时要在铝箔上系上一根火柴,其作用是______________________。
(3)集气瓶底部铺上一层细沙,其作用是______________________。
(4)实验中应观察到的现象是______________________________。
(5)用正确方法引燃铝箔,伸入装有氧气的集气瓶中后,未观察到铝箔剧烈燃烧的现象,可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
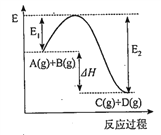
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol Na2CO3中含有___________个Na+。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体,在相同温度和相同压强条件下,体积最大的是____________。
(3)配制90 mL 0.1 mol/L CuSO4溶液,需要胆矾________g。
(4)氧化还原反应3S+6KOH=2K2S+K2SO3+3H2O中,氧化剂与还原剂的物质的量之比为_____________,若反应中消耗了0.6molS,则反应中转移的电子为________mol。
(5)现有下列10种物质:①H2O、②Mg、③CH3COOH、④NaOH、⑤CuSO4·5H2O、⑥碘酒、⑦C2H5OH、⑧盐酸,(将序号填在相应的空格内)其中,属于强电解质的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“铁与水蒸气的反应实验”。
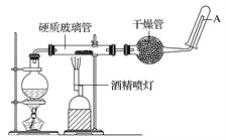
请回答该实验中的问题。
(1)写出该反应的反应方程式:__________________________________;并指明该氧化还原反应的还原剂是____________,氧化剂是______________。
(2)实验前必须对整套装置进行气密性检查,操作方法是_______________________________。
(3)圆底烧瓶中盛装有水,该装置受热后的主要作用是____________________________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是__________________。
(4)酒精灯和酒精喷灯点燃的顺序是__________________________________,为什么?___________________________________________________________________。
(5)干燥管中盛装的物质是________________________,作用是_______________________。
(6)试管中收集的气体是__________,如果要在A处玻璃管处点燃该气体,则必须对该气体进行____________________,方法是________________________________。这一操作的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 零族元素与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布
C. 同周期的X、Y元素,且电负性X>Y,则第一电离能也是X>Y
D. 基态原子p能级上半充满的元素一定位于p区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com