
【题目】下列物质中属于电解质,但在给定条件下不能导电的是
A. 液态氯化氢 B. 蔗糖 C. 铝 D. 稀硝酸
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
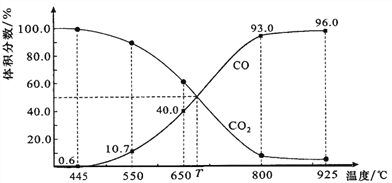
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为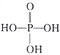 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
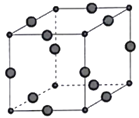
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的下列说法中正确的是( )
A. 在外电路中电子由正极流向负极
B. 在原电池中负极发生还原反应
C. 阳离子向正极方向移动
D. 原电池中正极一定是不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正确的是( )
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
途径③:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①的反应中体现了浓硝酸的强氧化性
B. 途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本
C. 由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子
D. 途径②、③比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29的Cu的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于________。
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组采用刻蚀废液(主要含CuCl2、FeCl3、FeCl2、HCl)制取Cu和Cu2Cl2,实验流程如下:

已知:Cu2Cl2是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。
(1)“预处理"时,需用Na2CO3调节溶被至微酸性而不是碱性,其原因是_____
(2)“还原Ⅰ”需在80℃条件下进行,适宜的加热方式为_______
(3)“还原Ⅱ”中,Cu2+参与反应的离子方程式为______
(4)“搅拌”时加入NaCl粉末的作用是________
(5)“过滤Ⅱ”得到的Cu2Cl2需用无水乙醇洗涤,并在真空干燥机内于70℃干燥2小时,冷却,密封包装。于70℃真空干燥的目的是_________
(6)①请设计从“过滤Ⅰ”所得滤渣中获取Cu的实验方案:_______(实验中可供选择的试剂:稀硫酸、稀硝酸、蒸馏水)。
②现欲测定途径a、b回收铜元素的回收率比,请补充实验方案:_______________,分别按途径a、b制取Cu和Cu2Cl2,测得Cu的质量为m1g,Cu2Cl2的质量为m2g,则途径a、b铜素的回收率比为________(铜元素回收率=产品中铜元素质量/废液中铜元素的质量×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com