
【题目】反应2Na2O2+2H2O═4NaOH+O2↑中,还原剂是( )
A.Na2O2B.H2O
C.NaOHD.O2
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。
(1)基态钛原子的价电子排布图为__________________;基态铝原子核外电子分布在____个能级上。
(2)许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是______________________。
(3)FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是________________________________。
(4)煅烧铁矿石常会生成SO2,SO2为_______分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为_______________。
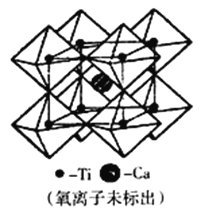
(5)钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被____个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被_____个氧离子包围。钙钛矿晶体的化学式为________________________。若该晶胞的边长为apm,则钙钛矿晶体的密度为_____________g·cm-3(用NA表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是( )
实验目的 | 实验方案 | |
A | 检验FeSO4晶体是否已氧化变质 | 将FeSO4样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
B | 探究浓度对化学反应速率的影响 | 取两支试管,各加入4mL0.5mol/L的KMnO4酸性溶液,然后向两支试管中分别加入2mL0.1mol/LH2C2O4(草酸)溶液和2mL0.2mol/LH2C2O4溶液比较反应褪色的快慢 |
C | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相中的水 |
D | 判断淀粉是否水解 | 向用稀硫酸作催化剂的淀粉水解液中加入适量银氨溶液后水浴加热,观察是否产生银镜 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素中,基态原子的价层电子排布式不正确的是( )
A. As 4s24p3 B. Cr 3d44s2 C. Ga 4s24p1 D. Ni 3d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是铝箔在氧气中燃烧的实验,请回答下列问题:
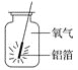
(1)铝在氧气中燃烧的化学方程式为______________________。
(2)实验时要在铝箔上系上一根火柴,其作用是______________________。
(3)集气瓶底部铺上一层细沙,其作用是______________________。
(4)实验中应观察到的现象是______________________________。
(5)用正确方法引燃铝箔,伸入装有氧气的集气瓶中后,未观察到铝箔剧烈燃烧的现象,可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
序号 | 实验内容 | 实验目的 |
A | 将FeCl3固体溶于少量浓盐酸中,再加蒸馏水稀释至所需浓度 | 配制氯化铁溶液 |
B | 常温下,将干电池的温度升高到40℃,其输出电流增大 | 证明干电池可将环境热能转化为电能 |
C | 向CuCl2溶液中加入NaOH调节pH>4 | 除去CuCl2的Fe3+杂质 |
D | 向BaSO4悬浊液中加入Na2CO3饱和溶液,过滤出的沉淀加入盐酸有气体生成 | 证明Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com