
【题目】下列实验方案能达到实验目的的是( )
实验目的 | 实验方案 | |
A | 检验FeSO4晶体是否已氧化变质 | 将FeSO4样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红 |
B | 探究浓度对化学反应速率的影响 | 取两支试管,各加入4mL0.5mol/L的KMnO4酸性溶液,然后向两支试管中分别加入2mL0.1mol/LH2C2O4(草酸)溶液和2mL0.2mol/LH2C2O4溶液比较反应褪色的快慢 |
C | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相中的水 |
D | 判断淀粉是否水解 | 向用稀硫酸作催化剂的淀粉水解液中加入适量银氨溶液后水浴加热,观察是否产生银镜 |
A. A B. B C. C D. D
【答案】C
【解析】A、硝酸具有强氧化性,可将Fe2+氧化成Fe3+,所以A不能检验FeSO4晶体因氧化而变质,即A错误;B、已知反应的方程式为5H2C2O4+2MnO4-+6H+![]() 2Mn2++10CO2↑+8H2O,所以两支试管中H2C2O4的量都不足,因此KMnO4酸性溶液都不会褪色,可能颜色会变浅,但不易观察,所以B错误;C、由于乙酸能与碳酸钠反应而除去,而乙酸乙酯在饱和碳酸钠溶液溶解度更小,所以通过分液即可提纯含有少量乙酸的乙酸乙酯,故C正确;D、银氨溶液中酸性溶液中会变质,所以不能直接向水解液中加入银氨溶液,应先加NaOH溶液中和到碱性,再加入银氨溶液,水浴加热,观察是否产生银镜,故D错误。因此本题答案应选C。
2Mn2++10CO2↑+8H2O,所以两支试管中H2C2O4的量都不足,因此KMnO4酸性溶液都不会褪色,可能颜色会变浅,但不易观察,所以B错误;C、由于乙酸能与碳酸钠反应而除去,而乙酸乙酯在饱和碳酸钠溶液溶解度更小,所以通过分液即可提纯含有少量乙酸的乙酸乙酯,故C正确;D、银氨溶液中酸性溶液中会变质,所以不能直接向水解液中加入银氨溶液,应先加NaOH溶液中和到碱性,再加入银氨溶液,水浴加热,观察是否产生银镜,故D错误。因此本题答案应选C。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
表2两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | — |
硼镁泥制取七水硫酸镁的工艺流程如下

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施_______________。
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式span>_____________________
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:__________________。
(4)加入硼镁泥调节pH=5~6目的是________________。
(5)得到的沉淀C的组成是_________________(填化学式),过滤Ⅲ需趁热过滤,原因是___________。
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是大气污染物,利用SO2→CaSO4→CaS转化可实现变废为宝。
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g)△H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s)△H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:_____________。
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g)![]() 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:

①该反应的△H__________0(填“>”或“<”,下同);图中M、N两点的平衡常数:KM_____KN。
②M点时的化学平衡常数K=____________。
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+)的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:

①图中a=_____________。
②该温度下,Ksp(CaSO4)=________________。
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为_____________________________。

(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的下列说法中正确的是( )
A. 在外电路中电子由正极流向负极
B. 在原电池中负极发生还原反应
C. 阳离子向正极方向移动
D. 原电池中正极一定是不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中科院大连化物所包信和团队研究甲烷高效转化获重大突破。催化原理如图所示,该研究彻底摒弃了高耗能的合成气制备过程,大大缩短了工艺路线,反应过程本身实现了二氧化碳的零排放,碳原子利用效率达到100%。关于该反应的下列说法错误的是

A. 催化剂降低了反应的活化能 B. CH4→CH3+H的过程需要吸收能量
C. 该反应符合绿色化学原理 D. CH3 是稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分是CuFeS2)是一种重要的化工原料,通过化学工艺可获得二(氨基丙酸)合铜[Cu(NH2CH2CH2COO)2]等产品。
(1)Cu2+基态核外电子排布式为________
(2)[Cu(NH2CH2CH2COO)2]的结构简式如图1所示。1mol[Cu(NH2CH2CH2COO)2]中含有σ键数目为_______;C、N、O三种元素的第一电离能由小到大的顺序是__________
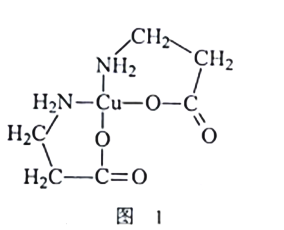
(3)黄铜矿在空气中灼烧得到废气和固体混合物。废气中SO2经催化氧化生成SO3,SO2分子中S原子轨道的杂化类型为_____。SO3分子的空间构型为______;固体混合物中含有一种化合物X,其晶胞如图2所示,化合物X的化学式为____________。
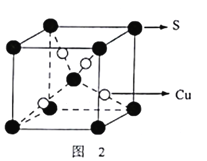 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com