
����Ŀ����ͭ��(��Ҫ�ɷ���CuFeS2)��һ����Ҫ�Ļ���ԭ�ϣ�ͨ����ѧ���տɻ�ö�(��������)��ͭ[Cu(NH2CH2CH2COO)2]�Ȳ�Ʒ��
��1��Cu2+��̬��������Ų�ʽΪ________
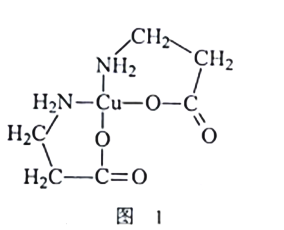
��2��[Cu(NH2CH2CH2COO)2]�Ľṹ��ʽ��ͼ1��ʾ��1mol[Cu(NH2CH2CH2COO)2]�к���������ĿΪ_______��C��N��O����Ԫ�صĵ�һ��������С�����˳����__________
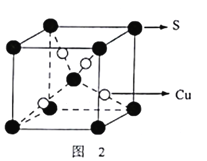
��3����ͭ���ڿ��������յõ������������������SO2������������SO3��SO2������Sԭ�ӹ�����ӻ�����Ϊ_____��SO3���ӵĿռ乹��Ϊ______�����������к���һ�ֻ�����X���侧����ͼ2��ʾ��������X�Ļ�ѧʽΪ____________��
 ��
��
���𰸡� [Ar]3d9��1s22s22p63s23p63d9 26NA C<O<N sp2 ƽ�������� Cu2S
����������1��Cu��29��Ԫ�أ�������Ų�ʽΪ1s22s22p63s23p63d104s1��ת��ΪCu2+��ʱ��Ӧ��ʧȥ�������������ӣ�������1s22s22p63s23p63d9��[Ar]3d9��
��2������ͼ1�Ľṹͼ��ÿһ���������ǦҼ���˫����һ���Ҽ���һ���м�������������һ����26���Ҽ�����1mol[Cu(NH2CH2CH2COO)2]�к���������ĿΪ26NA��ͬ���ڴ������ҵ�һ����������������N��2p�ܼ��İ����ȶ��ṹ�����Է�������˳��Ϊ��C<O<N��
��3�����ݼ۲���ӶԻ������ۣ�SO2������ԭ��S�ļ۵��Ӷ�Ϊ��2+(6-2��2)/2��3�ԣ�����S��sp2�ӻ������ݼ۲���ӶԻ������ۣ�SO3������ԭ��S�ļ۵��Ӷ�Ϊ��3+(6-3��2)/2��3�ԣ�����SO3��ƽ����������ͼ2��Sռ�ݶ�������ģ�����S��8��![]() + 1 = 2����Cu���ھ����ڲ�������Cu��4�������Ի�ѧʽΪCu2S��
+ 1 = 2����Cu���ھ����ڲ�������Cu��4�������Ի�ѧʽΪCu2S��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ� ��
ʵ��Ŀ�� | ʵ�鷽�� | |
A | ����FeSO4�����Ƿ����������� | ��FeSO4��Ʒ����ϡ�����,�μ�KSCN��Һ,�۲���Һ�Ƿ��� |
B | ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� | ȡ��֧�Թ�,������4mL0.5mol/L��KMnO4������Һ,Ȼ������֧�Թ��зֱ����2mL0.1mol/LH2C2O4(����)��Һ��2mL0.2mol/LH2C2O4��Һ�ȽϷ�Ӧ��ɫ�Ŀ��� |
C | �ᴿ��������������������� | ����������������������м����������̼������Һ,���÷�Һ,����ȥ�л����е�ˮ |
D | �жϵ����Ƿ�ˮ�� | ����ϡ�����������ĵ���ˮ��Һ�м�������������Һ��ˮԡ���ȣ��۲��Ƿ�������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ(��Ӧ����ʽ����ƽ)��Cu��2H2SO4(Ũ)![]() CuSO4��A����2H2O��ͨ����������������������⣺
CuSO4��A����2H2O��ͨ����������������������⣺
(1)A���ʿ��Ե���������γɡ���AӦ������______________(����ĸ������д)
a���� b���� c���� d������������ e������������
(2)SO2��O2�Ļ�������У���Ԫ�ص���������Ϊ70%����SO2��O2�����ʵ���֮����__________�����ֻ��������ܶ���ͬ��ͬѹ�������ܶȵ�_____����
(3)һ������ͭƬ��100mL 18mol/L ��ŨH2SO4��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�CuSO4�����ʵ���Ϊ_________mol��
(4)����Ӧ�����õ���CuSO4��Һ������Ba(OH)2��Һ��ַ�Ӧ�����ӷ���ʽ��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���H2C2O4��Һ����εμ�NaOH��Һ��������pc=-lgc����������Һ��pc(H2C2O4)��pc(HC2O4-)��pc(C2O42-)����ҺpH�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. �����£�Ka1(H2C2O4)=10-1.3
B. pH=xʱ��c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. M��ʱ��c(Na+)<2c(HC2O4-)+c(C2O42-)
D. ![]() ��pH�����߶�����
��pH�����߶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�����ˮ������Ӧ�����ڸ����£�����ˮ�����ɷ�����Ӧ�� Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ�����������ˮ�����ķ�Ӧʵ������
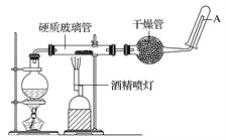
��ش��ʵ���е����⡣
��1��д���÷�Ӧ�ķ�Ӧ����ʽ��__________________________________����ָ����������ԭ��Ӧ�Ļ�ԭ����____________����������______________��
��2��ʵ��ǰ���������װ�ý��������Լ�飬����������_______________________________��
��3��Բ����ƿ��ʢװ��ˮ����װ�����Ⱥ����Ҫ������____________________________����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ��������__________________��
��4���ƾ��ƺ;ƾ���Ƶ�ȼ��˳����__________________________________��Ϊʲô��___________________________________________________________________��
��5���������ʢװ��������________________________��������_______________________��
��6���Թ����ռ���������__________�����Ҫ��A�������ܴ���ȼ�����壬�����Ը��������____________________��������________________________________����һ������Ŀ����________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�����Ϊa g��12Cԭ�ӵ�����Ϊb g����NA��ʾ�����ӵ�������ֵ�����в���ȷ����
A. ����ԭ�ӵ�Ħ������Ϊ![]() g/mol B. x g����ԭ�ӵ����ʵ�����
g/mol B. x g����ԭ�ӵ����ʵ�����![]() mol
mol
C. 1 mol����ԭ�ӵ�������aNA g D. y g����ԭ��������ԭ����Ϊ![]() NA
NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܴﵽԤ��Ŀ�ĵ���
��� | ʵ������ | ʵ��Ŀ�� |
A | ��FeCl3������������Ũ�����У��ټ�����ˮϡ��������Ũ�� | �����Ȼ�����Һ |
B | �����£����ɵ�ص��¶����ߵ�40����������������� | ֤���ɵ�ؿɽ���������ת��Ϊ���� |
C | ��CuCl2��Һ�м���NaOH����pH>4 | ��ȥCuCl2��Fe3+���� |
D | ��BaSO4����Һ�м���Na2CO3������Һ�����˳��ij��������������������� | ֤��Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��V mL��������Һ�к�Al3��a g��ȡV/4 mL��Һϡ�͵�4V mL��ϡ�ͺ���Һ��SO42-�����ʵ���Ũ����
A. 125a/9V mol/L B. 125a/18V mol/L
C. 125a/36V mol/L D. 125a/54V mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ʵ������0.4molL��1 NaOH��Һ480mL�����Ʒ������£�
��1�����Ƹ���Һ�����������:��Ͳ����ƽ��ҩ�ס��ձ�����������___��_____��
��2����������ƽȷ����___________g ����NaOH��
��3���������ƹ����г��������������ʹ�����Ƶ�NaOH��Һ��Ũ��ƫ�ߵ���_________����ʵ����û��Ӱ�����_____________�����ѡ�����ţ���
A�����õ�NaOH�л�������Na2O
B����������ƽ����һ����������NaOHʱ�����õ�С�ձ��ڱڲ�̫����
C��������Һ���õ�����ƿϴ����û�к��
D������NaOH���ձ����ܽ����������Һת�Ƶ�����ƿ�ڲ����Ž��к�������
E��ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ���
F�����ȷ��NaOH��Һ��������ݣ�ʱ����������ƿ�̶���
G������ҡ�Ⱥ�ֹ������Һ����ڿ̶��ߣ��ټ�����ˮ���̶��ߣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com