
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
【答案】d 3:4 10/7 0.1mol Cu2++SO42-+Ba2++2OH-= Cu(OH)2↓ +BaSO4↓
【解析】
(1)根据元素守恒判断A,再根据A判断分类;
(2)令混合气体的质量为100g,根据氧元素的质量分数计算S元素质量分数,进而计算S元素质量,再计算SO2的质量、氧气的质量,根据n=![]() 计算二者物质的量,根据M=
计算二者物质的量,根据M=![]() 计算平均相对分子质量,相同条件下,不同气体的密度之比等于其摩尔质量之比;
计算平均相对分子质量,相同条件下,不同气体的密度之比等于其摩尔质量之比;
(3)由反应可知,生成1molCuSO4转移2mol电子,该反应过程中转移了 0.2mol电子,生成0.1molCuSO4;
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应生成硫酸钡沉淀和氢氧化铜沉淀。
(1)根据元素守恒判断A为SO2,SO2是能与碱反应生成盐和水的氧化物,属于酸性氧化物,答案选d;
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则S元素的质量分数=1-70%=30%,令混合气体的质量为100g,则S元素质量=100g×30%=30g,故SO2的质量=![]() =60g,则氧气的质量=100g-60g=40g,则SO2的物质的量=
=60g,则氧气的质量=100g-60g=40g,则SO2的物质的量=![]() =
=![]() mol,O2的物质的量=
mol,O2的物质的量=![]() =
=![]() mol,则SO2与O2的物质的量之比为
mol,则SO2与O2的物质的量之比为![]() mol:
mol:![]() mol=3:4,二者平均相对分子质量=
mol=3:4,二者平均相对分子质量=![]() =
=![]() ,相同条件下,气体的摩尔质量之比等于其密度之比,所以混合气体的密度是同温同压下氧气密度的倍数=
,相同条件下,气体的摩尔质量之比等于其密度之比,所以混合气体的密度是同温同压下氧气密度的倍数=![]() =
=![]() ;
;
(3)由反应可知,生成1molCuSO4转移2mol电子,该反应过程中转移了 0.2mol电子,生成0.1molCuSO4;
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式是Cu2++SO42-+Ba2++2OH-= Cu(OH)2↓ +BaSO4↓。


科目:高中化学 来源: 题型:
【题目】二氧化硫是大气污染物,利用SO2→CaSO4→CaS转化可实现变废为宝。
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g)△H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s)△H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:_____________。
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g)![]() 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:

①该反应的△H__________0(填“>”或“<”,下同);图中M、N两点的平衡常数:KM_____KN。
②M点时的化学平衡常数K=____________。
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+)的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:

①图中a=_____________。
②该温度下,Ksp(CaSO4)=________________。
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为_____________________________。

(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。

已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29的Cu的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________(填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________。
(4)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于________。
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10gCaCO3粉末分别加入到下列溶液中,充分搅拌,各溶液中Ca2+的浓度最小的为
A. 10mL水 B. 10mL,0.01 mol·L-1盐酸溶液
C. 10mL,0.01mol·L-1Ca(NO3)2溶液 D. 10mL,0.1 mol·L-1K2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料,通过下图所示步骤能合成一种高分子涤纶G(转化过程中的部分反应条件及部分产物已略去):
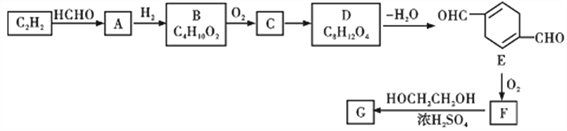
其中A、B、C、D分别代表一种有机物,B分子中无甲基。
己知:-C![]() CH+
CH+

请回答下列问题:
(1)A中含氧官能团名称为________,生成A的反应类型是__________,B的化学名称为__________________。
(2)B→C的化学反应方程式____________________。F和H2完全加成得到的物质的结构简式是_________。
(3)写出符合下列条件的E的同分异构体的结构简式_______________。
①含有苯环 ②属于酯类 ③可发生银镜反应 ④苯环上有两种不同环境的氢原子
(4)下列说法正确的是_______(填字母代号)
a.上述流程中,乙炔、有机物B、有机物E都可发生聚合反应
b.有机物E中所有原子共平面
c.35%~40%的甲醛(HCHO)溶液俗称福尔马林溶液,能使蛋白质变性
(5)请写出F生成G的化学方程式________________________。
(6)根据题给信息,写出用甲醛和乙醇为原料制备季戊四醇[C(CH2OH)4]的合成路线(其它试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
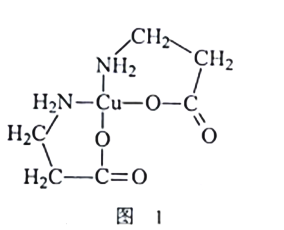
【题目】黄铜矿(主要成分是CuFeS2)是一种重要的化工原料,通过化学工艺可获得二(氨基丙酸)合铜[Cu(NH2CH2CH2COO)2]等产品。
(1)Cu2+基态核外电子排布式为________
(2)[Cu(NH2CH2CH2COO)2]的结构简式如图1所示。1mol[Cu(NH2CH2CH2COO)2]中含有σ键数目为_______;C、N、O三种元素的第一电离能由小到大的顺序是__________
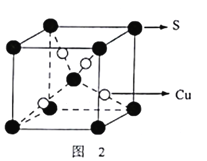
(3)黄铜矿在空气中灼烧得到废气和固体混合物。废气中SO2经催化氧化生成SO3,SO2分子中S原子轨道的杂化类型为_____。SO3分子的空间构型为______;固体混合物中含有一种化合物X,其晶胞如图2所示,化合物X的化学式为____________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 苯乙炔中最多有四个原子共直线
B. 2-甲基-1,3-丁二烯与Br2的加成产物有4种
C. 甲苯在一定条件下与H2完全反应,产物的一氯代物的同分异构体有4种
D. 已知具有单双键交替长链(如:—CH=CH—CH=CH—CH=CH—)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com