
【题目】将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标况)氢气,原混合物的质量可能是( )
A. 2 g B. 1 g C. 8 g D. 10 g
【答案】C
【解析】
根据化学反应方程式中化学计量数的关系计算。
用极端假设法:n(H2)=V/Vm=2.8/22.4=0.125mol,得到氢气的质量为:m=nM=0.125×2=0.25g,①假设原混合物全为Zn,Zn+H2SO4=ZnSO4+H2↑n(Zn)=n(H2)=0.125mol,即m(Zn)=0.125mol×65g/mol=8.125g;②假设原混合物全为Al:根据2Al+3H2SO4=Al2(SO4)3+3H2↑,n(H2):n(Al)=3:2,n(Al)=![]() n(H2),m(Al)=2.25g,以上所得是把原混合物假设成纯净物的结果,但事实上它是混合物,所以取值范围就应该在二者之间
n(H2),m(Al)=2.25g,以上所得是把原混合物假设成纯净物的结果,但事实上它是混合物,所以取值范围就应该在二者之间
故混合物质的质量肯定在2.25g-8.125g之间,故C正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子层结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. X的最高价氧化物的水化物能溶解在Z的最高价氧化物的水化物溶液中
B. W、X、Z的简单离子均能促进水的电离
C. W的氢化物与X、Y、Z的氧化物均不反应
D. 原子半径:X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4 ![]() 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是大气污染物,利用SO2→CaSO4→CaS转化可实现变废为宝。
回答下列问题:
(1)已知:Ⅰ.C(s)+CO2(g)=2CO(g)△H1=+172kJ·mol-1;
Ⅱ.CaSO4(s)+2C(s)=2CO2(g)+CaS(s)△H2=+226kJ·mol-1。
若某反应的平衡常数表达式为K=c4(CO),请结合反应Ⅰ、Ⅱ写出此反应的热化学方程式:_____________。
(2)向体积为2L的恒容密闭容器中充入1molSO2、4molCO和催化剂,发生反应
SO2(g)+2CO(g)![]() 2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:
2CO2(g)+S(g) △H,测得温度对SO2的转化率及催化剂效率的影响如图1所示:

①该反应的△H__________0(填“>”或“<”,下同);图中M、N两点的平衡常数:KM_____KN。
②M点时的化学平衡常数K=____________。
(3)向浓度均为0.01mol·L-1的Na2SO4和Na2CO3混合溶液中滴加氯化钙溶液,测得分散系中两种酸根离子的浓度随c(Ca2+)的变化如图2所示[已知:Ksp(CaCO3)=3×10-9]:

①图中a=_____________。
②该温度下,Ksp(CaSO4)=________________。
(4)某研究小组设计图3所示装置将副产品CO转化为CH4和Q。该电解总反应的离子方程式为_____________________________。

(5)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入SO2至过量,请画出生成沉淀的物质的量(mol)与通入SO2体积(L)的关系图。______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,也是重要的非金属元素。
回答下列问题:
(1)基态磷原子的价电子排布式为________________。
(2)N和P同主族且相邻,PF3和NH3都能与许多过渡金属形成配合物,但NF3却不能与过渡金属形成配合物,其原因是____________________________________________。
(3)磷酸为三元酸,其结构式为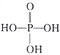 。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
。PO43-的空间构型为____________;写出一种与PO43-互为等电子体且属于非极性分子的化学式:____________________。
(4)将磷酸加热可发生分子间脱水生成焦磷酸(H4P2O7)、三磷酸以及高聚磷酸,焦磷酸的酸性强于磷酸的原因是______________________________________________________。
(5)磷化硼(BP)是受到高度关注的耐磨涂料。BP中B和P原子均形成共价键,其中存在配位键,配位键中提供孤电子对的是____________(填元素符号)原子;磷化硼的晶体类型是____________,其中B原子的杂化方式是____________杂化,1molBP中含有____________molB-P键。
(6)Cu3P的晶胞结构如图所示,P3-的配位数为____________,Cu+的半径为apm,P3-的半径为bpm,阿伏加德罗常数的值为NA,则CuP晶体的密度为____________g·cm-3(用含a、b、NA的代数式表示)。
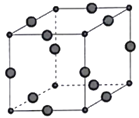
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的下列说法中正确的是( )
A. 在外电路中电子由正极流向负极
B. 在原电池中负极发生还原反应
C. 阳离子向正极方向移动
D. 原电池中正极一定是不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料,通过下图所示步骤能合成一种高分子涤纶G(转化过程中的部分反应条件及部分产物已略去):
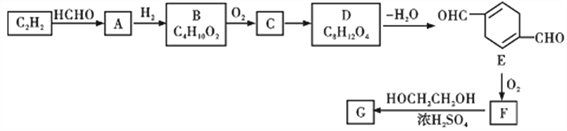
其中A、B、C、D分别代表一种有机物,B分子中无甲基。
己知:-C![]() CH+
CH+

请回答下列问题:
(1)A中含氧官能团名称为________,生成A的反应类型是__________,B的化学名称为__________________。
(2)B→C的化学反应方程式____________________。F和H2完全加成得到的物质的结构简式是_________。
(3)写出符合下列条件的E的同分异构体的结构简式_______________。
①含有苯环 ②属于酯类 ③可发生银镜反应 ④苯环上有两种不同环境的氢原子
(4)下列说法正确的是_______(填字母代号)
a.上述流程中,乙炔、有机物B、有机物E都可发生聚合反应
b.有机物E中所有原子共平面
c.35%~40%的甲醛(HCHO)溶液俗称福尔马林溶液,能使蛋白质变性
(5)请写出F生成G的化学方程式________________________。
(6)根据题给信息,写出用甲醛和乙醇为原料制备季戊四醇[C(CH2OH)4]的合成路线(其它试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com