
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:

已知:i.Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSOa4]2+;
ii.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
iii.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol/L。请回答下列问题:
(1)铈的原子序数是58,它在元素周期表的位置是_________________________。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是____________________、_________________(写出2种即可)。
(3)“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为________________。浸出的过程中常加入适量的Na2SO4浓溶液,其作用是_____________________________。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
(5)“反萃取”中加H2O2的主要反应离子方程式为_______________________。在“反萃取”后所得水层中加入1.0mol/L的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol/L],溶液中c(CO32-)约为______________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
【答案】 第六周期 III B族 矿石粉碎成细小颗粒 通入大量空气 CeO2+4H++SO42-![]() [CeSO4]2++H2O 增大c(SO42-),以提高[CeSO4]2+的浸出率 [CeSO4]2+、Ce4+ 2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
[CeSO4]2++H2O 增大c(SO42-),以提高[CeSO4]2+的浸出率 [CeSO4]2+、Ce4+ 2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】(1)根据稀有气体氙的原子序数为54,位于第5周期0族,因此下推一个周期,即第6周期,第IA族,IIA族,原子序数分别为55、56,接下来为镧系,57-71之间,位于第六周期、III B族;所以铈的原子序数是58,位于第六周期、III B族;正确答案:第六周期、III B族。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是矿石粉碎成细小颗粒、通入大量空气等;正确答案:矿石粉碎成细小颗粒、通入大量空气。
(3)由题意Ce4+能与SO42-结合成[CeSO4]2+,则“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为CeO2+4H++SO42-![]() [CeSO4]2++H2O;正确答案:CeO2+4H++SO42-
[CeSO4]2++H2O;正确答案:CeO2+4H++SO42-![]() [CeSO4]2++H2O 。随着溶液中c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,以提高[CeSO4]2+的浸出率;正确答案:CeO2+4H++SO42-
[CeSO4]2++H2O 。随着溶液中c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,以提高[CeSO4]2+的浸出率;正确答案:CeO2+4H++SO42-![]() [CeSO4]2++H2O;增大c(SO42-),以提高[CeSO4]2+的浸出率。
[CeSO4]2++H2O;增大c(SO42-),以提高[CeSO4]2+的浸出率。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+,该反应为可逆反应,萃取后水层中还存在的含铈元素的微粒主要是[CeSO4]2+、Ce4+,经处理后可循环使用;正确答案:[CeSO4]2+、Ce4+。
Ce(H2n-4A2n)+4H+,该反应为可逆反应,萃取后水层中还存在的含铈元素的微粒主要是[CeSO4]2+、Ce4+,经处理后可循环使用;正确答案:[CeSO4]2+、Ce4+。
(5)根据流程图,“反萃取”中加H2O2后Ce4+转化为Ce3+,说明H2O2作还原剂,被Ce4+氧化生成氧气,反应的离子方程式为:2Ce4++H2O2=2Ce3++O2↑+2H+ ;由题意可知,常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1,则Ksp[Ce2(CO3)3]=(2![]() 10-6)2
10-6)2![]() (3
(3![]() 10-6)3=1.08
10-6)3=1.08![]() 10-28,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)为
10-28,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)为![]() 1
1![]() 10-6mol/L;正确答案:2Ce4++H2O2=2Ce3++O2↑+2H+ ;1×10-6mol/L。
10-6mol/L;正确答案:2Ce4++H2O2=2Ce3++O2↑+2H+ ;1×10-6mol/L。
(6)CeO2消除CO尾气的过程中,CO是还原剂被CeO2氧化为CO2,CeO2作氧化剂,被CO还原为CeO2(1-x),反应的化学方程式为:2xCO+CeO2=CeO2(1-x)+2xCO2;正确答案:2xCO+CeO2=CeO2(1-x)+2xCO2。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
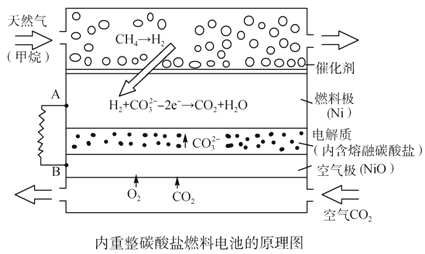
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N A 代表阿伏加德罗常数的值,下列说法正确的是
A. 1 mol Na在空气中完全燃烧,转移的电子数为2 N A
B. 常温下,2.7 g铝与足量NaOH溶液反应,消耗0.1 N A个OH-
C. 0.1 mol Fe 与足量水蒸气反应,生成H2的分子数为0.1 N A
D. 11.2 L Cl2含有的原子数为N A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
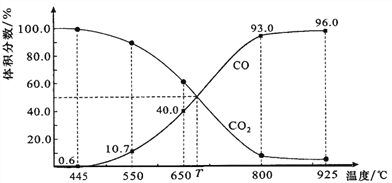
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E 是合成一种眼科表面麻醉用药的中间体,其合成路线如下:

(1)E 中的含氧官能团名称为硝基、_________、____________(写两种)。
(2)D→E 的反应类型为________________________。
(3)反应A→B 的化学方程式为_________________________。从整个流程看,设计A→B 这一步的目的是________________________________________。
(4)D 有多种同分异构体,同时满足下列条件的D 的同分异构体(不含立体异构)有____种,其中属于a氨基酸的同分异构体的结构简式为_________________________。(不写立体异构)。
①分子中同时含有苯环、醛基、羧基和氨基,且分子中有一个手性碳原子;②分子中有6 种不同化学环境的氢;③不能与FeCl3溶液发生显色反应。
(5)请以![]() 和C2H5OH 为有机原料制备医药中间体(
和C2H5OH 为有机原料制备医药中间体(![]() ),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
),写出制备的合成路线流程图( 无机试剂任用,合成路线流程图示例见本题题干)。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A. 2HI![]() H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
H2(g) + I2(g)的平衡体系,增大压强可是颜色加深
B. 氯水中存在下列平衡:Cl2 + H2 ![]() HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液的颜色变浅
C. 在合成氨的工业生产中要及时将生成的氨气分离出去
D. 可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com