
【题目】Ⅰ聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_________________________________;
(2)反应①的化学方程式为_________________________________________________;
(3)写出以下反应类型:反应②___________________;反应③_____________________。
II写出下列物质的结构简式或系统命名:
(1)2,4,6—三甲基辛烷__________________________________________________;
(2)3—甲基—1—丁炔 ____________________________________________________;
(3)间甲乙苯_________________________________________________________;
(4)苯乙烯_________________________________________________________.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在
C. 用盐酸酸化后,滴入AgNO3溶液产生白色沉淀,说明氯水中有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:

(1) ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2) 稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是_________
A.二氧化氯可广泛用于工业和饮用水处理
B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
C.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为______________________。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 __________________,此法相比欧洲方法的优点是______________________。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____________________________。此法提高了生产及储存、运输的安全性,原因是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________.
(2)A、B、H的化学式:A__________、B__________、 H________.
(3)①H2O2分子的电子式为______________。
②写出C的酸性溶液与双氧水反应的离子方程式: _______________________。
(4)写出鉴定E中阳离子的实验方法和现象:_______________________。
(5)在C溶液中加入与C等物质的量的Na 2 O 2 ,恰好使C转化为F,写出该反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为__________________。
(2)装置A中总反应的离子方程式为____________________________。
(3)装置D中总反应的离子方程式为_____________________________。
(4)若装置E的目的是在Cu材料上镀银,则X为________,极板N的材料为__________。
(5)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:

请回答:
(1)试剂1为____________(填化学式),①~④转化过程中____________消耗能量最多;
(2)沉淀B的化学式为__________,该物质除了用于金属冶炼以外,还可用作_____________;
(3)电解F,当转移6mol电子时,可制得铝 _____________g;
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有__________(填化学式);
(5)②中发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氟化碘(IF5)是重要的卤氟化物,IF5可与水反应IF5+3H2O=HIO3+5HF,生成的HIO3 与KI在酸性下生成游离碘IO3-+5I-+6H+=3I2+3H2O。用标准硫代硫酸钠溶液滴定碘发生反应2Na2S2O3+I2=Na2S4O6+2NaI即可分析IF5含量,若己知滴定耗用硫代硫酸钠的物质的量为0.3mol,则分析的试样中IF5的物质的量为
A. 0.05mol B. 0.2mol C. 0.lmol D. 0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
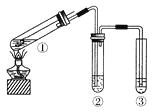
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
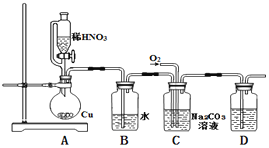
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com