
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
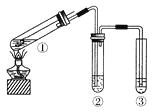
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下图是海水综合利用的部分工业流程图:
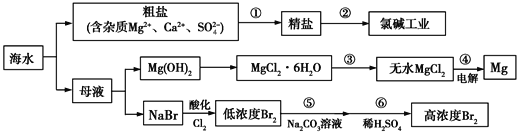
Ⅰ.在过程①中应加入的试剂分别为A.Na2CO3溶液、B.盐酸、C.BaCl2溶液、D.NaOH溶液,这4种试剂添加的合理顺序是____(填序号);过程①中须完成的实验操作分别为a.多步过滤、b.蒸发浓缩、c.冷却结晶,操作a中需要的玻璃仪器是烧杯、__________。
Ⅱ.(1)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是____。
A.H2 B.Cl2 C.Na2CO3 D.NaOH
(2)如图所示是离子交换膜法电解原理示意图,两极均用惰性电极材料。精制饱和食盐水进入阳极室,H+在右电极上发生____反应(填“氧化”或“还原”),所使用的离子交换膜的主要作用是____________。

(3)操作人员欲用pH试纸测定右室溶液酸碱度,其操作方法为________。
Ⅲ.过程④制取金属镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Ⅳ.过程⑤用纯碱溶液吸收Br2,发生的主要反应为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,则吸收1 mol Br2,转移的电子数为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_________________________________;
(2)反应①的化学方程式为_________________________________________________;
(3)写出以下反应类型:反应②___________________;反应③_____________________。
II写出下列物质的结构简式或系统命名:
(1)2,4,6—三甲基辛烷__________________________________________________;
(2)3—甲基—1—丁炔 ____________________________________________________;
(3)间甲乙苯_________________________________________________________;
(4)苯乙烯_________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存
B. 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成
C. 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
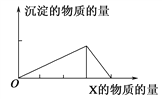
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: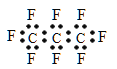
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+
B. ![]() =10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
=10-13mol·L-1的溶液:Na+、AlO2-、OH-、NO3-
C. 0.1 mol·L-1NH3·H2O溶液:K+、Na+、NO3-、Cl-
D. 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃ 时,下列酸的电离常数: 醋酸(CH3COOH):1.75×10-5氢氰酸(HCN) :6.2×10-10,氢氟酸(HF):7.2×10-4,甲酸(HCOOH): 1.77×10-4。下列说法不正确的是( )
A. 物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是:氢氟酸
B. 物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3COOH 的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液大
C. 0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液中:c(CN-)+)
D. 等浓度的NaCN 和HCOONa 混合溶液中:c(OH-)=c(H+)+c(HCN)+c(HCOOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com