
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
(1)在这些元素中,金属性最强的元素是 ,最活泼的非金属元素是 ;
化学性质最不活泼的是: ;
在⑤~⑧元素中原子半径最小的是 ;(填元素符号)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物是 ,碱性最强的
化合物 ,呈两性的氢氧化物是 ;(填化学式)
(3) 比较②、③对应氢化物的稳定性: > (用化学式表示)
(4)表示⑧与⑩的化合物的电子式 ,
该化合物含的化学键类型是 。(填“离子键”或“共价键”)
(5)写出⑧的单质与⑤的最高价氧化物的水化物的溶液反应的离子方程式:
。
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
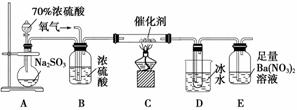
 ①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
②实验过程中,需要通入氧气。试写出一个用如右图所示装置制取氧气的化学方程式:____________________________________________。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是____________________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
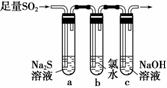
①能说明二氧化硫具有氧化性的实验现象为_________________________________
________________________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )
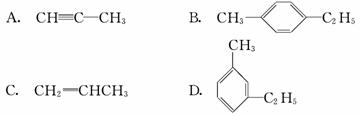
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2(g)  2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B.②③⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制取ClO2的化学反应:2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4,下列说法正确的是( )
A.SO2在反应中被还原 B.NaClO3在反应中失去电子
C.H2SO4 在反应中作氧化剂 D.1mol氧化剂在反应中得到1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种碳架结构如下的烃,下列描述不正确的是( )

A.a和d互为同分异构体
B.b和c是同系物
C.a和d都能发生加成反应
D.b、c、d都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机物结构、性质相关的叙述中,正确的是( )
A.乙醇与金属钠反应比水与金属钠反应更剧烈
B.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色
C.蛋白质、淀粉、纤维素、蔗糖都属于有机高分子化合物
D.乙酸、甲酸甲酯和羟基乙醛( )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574 kJ·mol-1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48 L CH4还原NO2至N2则放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的氧化物(用NOx表示)是大气污染物,必须进行处理。
(1)汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。
①汽车尾气中的CO来自于____________________,NO来自于_____________________。汽车尾气对环境的危害主要有________________________(至少填两种)。
②汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应的化学方程式可表示为__________________________。
(2)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO 5N2+6H2O,8NH3+6NO2
5N2+6H2O,8NH3+6NO2 7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
7N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理,若NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后得到一种钠盐,该钠盐的化学式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com