
| A. | 乙醇的结构简式:C2H6O | |
| B. | 硫离子的结构示意图: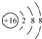 | |
| C. | 氮气的电子式: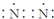 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
分析 A、有机物的结构简式必须表示出官能团;
B、硫离子是硫原子得2个电子形成的;
C、氮原子的最外层有5个电子;
D、氢氧化钡是强电解质,能在溶液中完全电离为1个钡离子和2个氢氧根.
解答 解:A、有机物的结构简式必须表示出官能团,则乙醇的结构简式为:C2H5OH,故A错误;
B、硫离子是硫原子得2个电子形成的,故结构示意图为 ,故B正确;
,故B正确;
C、氮原子的最外层有5个电子,故氮原子之间形成的是三键,故电子式为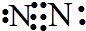 ,故C错误;
,故C错误;
D、氢氧化钡是强电解质,能在溶液中完全电离为1个钡离子和2个氢氧根,故电离方程式为:Ba(OH)2═Ba2++2OH-,故D错误.
故选B.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、原子结构示意图、结构式等化学用语的表示方法,明确原子结构示意图与离子结构示意图的区别,试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题: ,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).
,A、C、F三种元素形成的化合物CA4F为离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 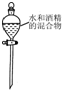 分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. | 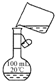 配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应区分淀粉溶液和食盐水 | |
| B. | 用品红溶液区分SO2与CO2气体 | |
| C. | 用石蕊试液区分KOH溶液与NaOH溶液 | |
| D. | 用碘水区分淀粉溶液与蛋白质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
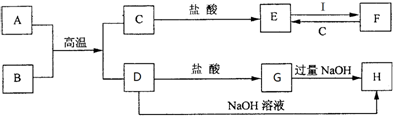

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 专一性 | B. | 多样性 | C. | 高效性 | D. | 适应性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com