
��֪H2(g)��Br2(l)��2HBr(g) ��H����72 kJ/mol������1mol Br2(l)��Ҫ���յ�����Ϊ30kJ����������������±���
| | H2(g) | Br2(g) | HBr(g) |
| 1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | a | 369 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ�� | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| ���ܣ�kJ/mol�� | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| c(Br-) |
| c(Cr-) |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
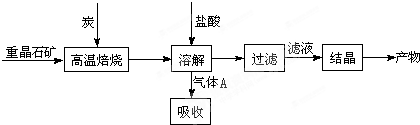
��Ŀ�����л�ѧ ��Դ��2014�����ʡ����ƽ��ɽ�������и�����һ�ε������ۻ�ѧ�Ծ��������棩 ���ͣ������
�״���һ�����͵���Դ��
��1���ϳ��������ΪH2��CO���������״�����Ҫԭ�ϣ���д���ɽ�̿��ˮ�ڸ�������ȡ�ϳ����Ļ�ѧ����ʽ ��
��2����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
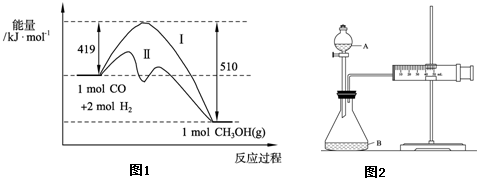
��3�����ݻ�Ϊl L���ܱ������У���CO��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��

����˵����ȷ���� ������ţ�
A���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊv(CH3OH)= (mol��L-1��min-1)
(mol��L-1��min-1)
B���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ�
C���÷�ӦΪ���ȷ�Ӧ
D������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ��С
��С
��4����T1�¶�ʱ����1 mol CO��2mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����COת����Ϊa���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ��
��5����ֱ���Լ״�Ϊȼ�ϵĵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ ������ԭ�����ΪNaOH���ҵ�ع���һ��ʱ�������ֻ��Na2CO3����ʱ��Һ�и�����Ũ�ȴ�С��ϵΪ
����֪Ksp(AgCl)=1.56��10-10 ��Ksp(AgBr)=7.7��10-13 ��Ksp(Ag2CrO4)=9��10-11��ij��Һ�к���C1-�� Br-��CrO42-��Ũ�Ⱦ�Ϊ0.010mo1��L-1�������Һ����μ���0.010mol��L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com