
【题目】纯碱是一种重要的化工原料,对于“氨碱法”和“联合制碱法”的分析中,错误的是( )
A.主反应的原理相同B.二氧化碳来源不同
C.都有氨的循环利用D.都具有一定局限性
【答案】C
【解析】
①氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,向饱和食盐水中先通入氨气,再通入二氧化碳气体NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3 ![]() Na2CO3+CO2↑+H2O,得到碳酸钠,然后在氯化铵溶液中加入氧化钙回收氨气;②联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3
Na2CO3+CO2↑+H2O,得到碳酸钠,然后在氯化铵溶液中加入氧化钙回收氨气;②联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3 ![]() Na2CO3+CO2↑+H2O,在氯化铵溶液中加入氯化钠,使氯化铵析出,得到碳酸钠和氯化铵两种主要产品。
Na2CO3+CO2↑+H2O,在氯化铵溶液中加入氯化钠,使氯化铵析出,得到碳酸钠和氯化铵两种主要产品。
A.两种方法的主反应的原理相同,均为NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl、2NaHCO3 ![]() Na2CO3+CO2↑+H2O,故A正确;
Na2CO3+CO2↑+H2O,故A正确;
B.氨碱法中的二氧化碳来自于生石灰的煅烧,联合制碱法中中的二氧化碳来自于合成氨厂制取氢气时的废气,二氧化碳来源不同,故B正确;
C.氨碱法中有氨的循环利用,“联合制碱法”得到的产品为碳酸钠和氯化铵,循环利用的物质是NaCl和CO2,故C错误;
D.氨碱法的原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了。较氨碱法而言,联合制碱法中用氨量较大,在有些情况下不适用,产品的纯度略低于索尔维法即氨碱法,二者都具有一定局限性,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】2020年1月在武汉爆发了新型冠状病毒肺炎,引起了全世界人民的关注。瑞德西韦(remdesivir)是一种可能的特效药,其结构简式如图所示,下列说法不正确的是(磷酸酯与酯性质类似)( )
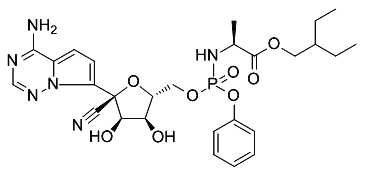
A.瑞德西韦的分子式是C27H32N6O8P
B.已知一个碳原子连接四个不同的原子(或基团)是具有手性的,瑞德西韦具有的手性碳原子有5个
C.若只考虑酯键的水解,瑞德西韦在水解后会成为4个分子
D.瑞德西韦的合成原料之一可能有苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴乙烷(CHBr2—CHBr2)是一种无色透明液体,密度2.967g·mL-1,难溶于水,沸点244℃,可用作制造塑料的有效催化剂等。用电石(主要成分CaC2,少量CaS、Ca3P2、Ca3AS2等)和Br2等为原料制备少量四溴乙烷的装置(夹持装置已省略)如图1所示。
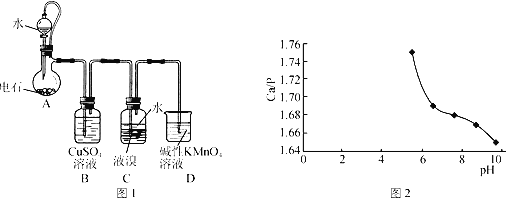
(1)装置A中CaC2能与水剧烈发生反应:CaC2+2H2O→Ca(OH)2+C2H2↑。为了得到平缓的C2H2气流,除可用饱和食盐水代替水外,还可采取的操作方法是__。
(2)装置B可除去H2S、PH3及AsH3,其中除去PH3的化学方程式为__(PH3还原性较强,氧化产物是磷酸)。
(3)装置C中在液溴液面上加入一层水的目的是__;装置C中反应已完成的现象是__;从装置C反应后的体系得到并纯化产品,需要进行的操作有__。
(4)一种制备Ca10(PO4)6(OH)2的原理为10Ca(OH)2+6H3PO4=Ca10(PO4)6(OH)2↓+18H2O。请设计用装置A得到的石灰乳等为原料制备Ca10(PO4)6(OH)2的实验方案:向烧杯中加入0.25L含0.5mol·L-1Ca(OH)2的石灰乳,_,在100℃烘箱中烘干1h。
已知:
①Ca10(PO4)6(OH)2中Ca/P比理论值为1.67。影响产品Ca/P比的主要因素有反应物投料比及反应液pH。
②在95℃,pH对Ca/P比的影响如图2所示。
③实验中须使用的试剂:含0.5mol·L-1Ca(OH)2的石灰乳、0.3mol·L-1磷酸及蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
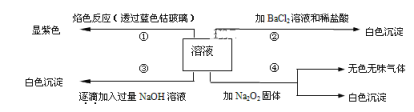
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、Ba2+、K+、Cl-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
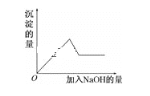
第③个实验中,生成白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:
(1)在原溶液中一定存在的离子有___________________________。
(2)写出第③个实验中发生反应的离子方程式___________________。
(3)第④个实验中加入Na2O2固体发生反应时氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=__;根据图,升高温度,K值将__(填“增大”、“减小”或“不变”)。
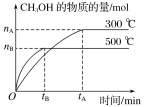
(2)500℃时,从反应开始到化学平衡状态,以H2的浓度变化表示的化学反应速率是__(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.υ生成(CH3OH)=υ消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
(1)①—⑩中,最活泼的金属元素是___________________(写元素符号);最不活泼的元素是_______(写元素符号)。
(2)④、⑤的简单离子,其半径更大的是________(写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是_________(填化学式)。
(4)元素的非金属性:①_______⑦(填“>”或“<”)。
(5)①—⑨的最高价氧化物的水化物中:酸性最强的是___________(填化学式),既能与酸反应又能与碱反应的是___________(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂
②NH4NO2仅是还原剂
③NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④
C. ②③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com