
A. ×100% ×100% | B. ×100% ×100% |
C. ×100% ×100% | D. ×100% ×100% |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格: | | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.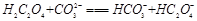 |
B.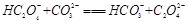 |
C.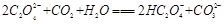 |
D.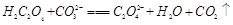 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com